Sie sind hier: Startseite > Harnleiter > Morbus Ormond
Retroperitoneale Fibrose (Morbus Ormond)
Definition des Morbus Ormond
Der Morbus Ormond (Retroperitoneale Fibrose) ist eine ätiologisch unklare Erkrankung mit zunehmender Fibrose des Retroperitoneums und Kompression darin enthaltender Leitungsstrukturen (Vaglio u.a., 2006).
Epidemiologie des Morbus Ormond
Erkrankungsbeginn 40–60 Lebensjahre, Männer:Frauen = 2:1. Prävalenz 1–2/100000 Einwohner.Ätiologie des Morbus Ormond
Unklare Ätiologie:
Bei 70 % der Patienten ist die Ätiologie der retroperitonealen Fibrose unklar. Vermutet wird ein Autoimmunprozess im Sinne einer Periaortitis (autoallergische Reaktion auf Arteriosklerose) als initialer pathophysiologischer Mechanismus, welcher sich über das Retroperitoneum ausdehnt. Weiterhin gibt es Hinweise auf eine lokale Manifestation einer systemischen erhöhten Bereitschaft für Autoimmunerkrankungen (siehe unten Assoziation mit fibrotischen Erkrankungen).
Bekannte Auslöser und Risikofaktoren der retroperitonealen Fibrose:
Medikamente:
Mutterkornalkaloide, β-Blocker, Phenacetin, LSD, Haloperidol, Amphetamine, Reserpin.
Infektionen:
Lymphangitis, chronisch entzündliche Darmerkrankungen, Gonorrhoe (Tripper), Syphilis, Tuberkulose, chronische Harnwegsinfekte, Sarkoidose.
Assoziation mit fibrotischen Erkrankungen:
sklerosierende Mediastinitis, sklerosierende Cholangitis, orbitaler Pseudotumor und Riedel-Thyreoiditis. Bei Kindern Assoziation mit systemischem Lupus erythematodes oder juveniler rheumatoider Arthritis.
Sonstige:
Bestrahlung, retroperitoneale Blutungen, Beckenchirurgie, Purpura Schönlein-Hennoch.
Pathologie des Morbus Ormond
Derbe bindegewebige Masse, welche die großen retroperitonealen Gefäße umgibt und auch den Ureter umfassen und infiltrieren kann (Retroperitoneale Fibrose). Die kraniokaudale Ausdehnung reicht i. d. R. vom Nierenhilus bis zum Promontorium des Os sacrum. Am Rand der Fibrose finden sich aktive Entzündungszeichen im Bindegewebe (Lymphozyten, Plasmazellen, Histiozyten). Das Bindegewebe im Zentrum ist inaktiv und zeigt keine Entzündungszeichen.
Klinik des Morbus Ormond
- Rückenschmerzen: konstante dumpfe Schmerzen, beginnend in den Flanken mit Ausstrahlung in den Unterbauch.
- Unspezifische Symptome wie Gewichtsverlust, Krankheitsgefühl, Übelkeit und Erbrechen am Anfang des entzündlichen Prozesses. Eine Lymphadenopathie besteht nicht.
- Im späten Verlauf Symptome durch die Urämie.
Diagnose des Morbus Ormond
Labor:
BSG und CRP erhöht. Weiterhin wichtig sind Kreatinin, Elektrolyte, Differentialblutbild, Autoantikörper (ANA, ANCA), Immunglobuline, Rheumafaktor, bei Männern PSA, AFP, HCG, LDH.
Sonographie:
Die Sonographie der Nieren identifiziert zuverlässig Harnstau. Eine verminderte Dicke des Nierenparenchmyms sind Hinweise auf eine chronische Niereninsuffizienz. Periaortal kann bei guten Bedingungen die retroperitoneale Bindegewebsmasse dargestellt werden.
CT oder MRT:
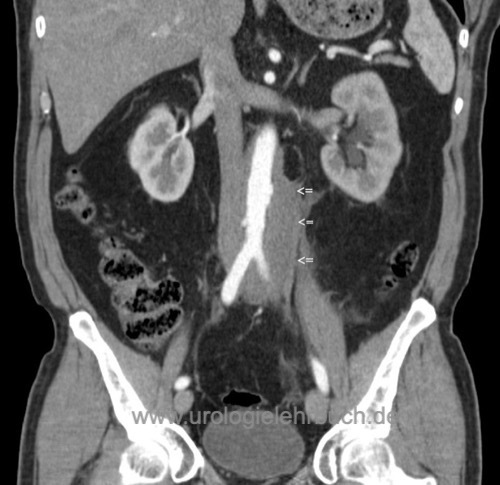
CT- oder MRT-Abdomen zeigt eine flache Raumforderung, welche die großen Gefäße und den Ureter umgibt [Abb. CT bei Morbus Ormond]. Weiterhin kann über die Parenchymdicke die Funktion der Nieren eingeschätzt werden.
Urogramm:
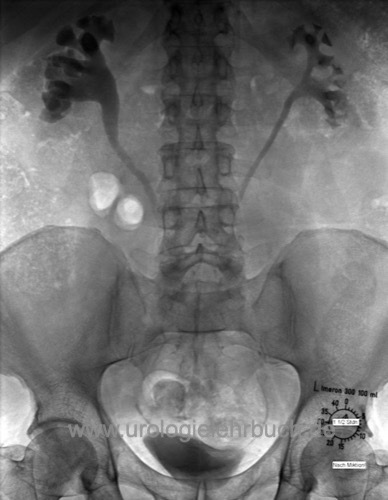
Zeichen der Hydronephrose beidseits, mit medialer Verlagerung der proximalen und mittleren Ureteren [Abb. Urogramm bei Morbus Ormond]. Das Urogramm sollte nur bei fehlender Verfügbarkeit der Schnittbildgebung durchgeführt werden.
Retrograde Pyelographie:
indiziert vor allem bei Niereninsuffizienz und vor endoskopischer Therapie. Radiologische Zeichen wie im Urogramm, Ausschluss einer intrinsischen Ureterobstruktion.
Nierenfunktionsszintigraphie:
indiziert zur Bestimmung der seitengetrennten Nierenfunktion und zur Objektivierung der Harnabflussstörung, insbesondere als Ausgangsbefund vor einer Therapie und bei V. a. Nierenfunktionsverlust.
Perkutane Biopsie:
zum Ausschluss eines Malignoms, insbesondere bei V. a. Lymphom (BB, Lymphadenopathie) oder bei Malignomen in der Anamnese. Bei typischer Klinik und radiologischen Kriterien des M. Ormond ist es umstritten, ob eine Biopsie vor Beginn der medikamentösen Therapie notwendig ist.
Differentialdiagnose des Morbus Ormond
Am häufigsten Lymphom, selten Carcinoid, multiples Myelom, Pankreaskarzinom, Metastasen eines Prostatakarzinoms, retroperitoneales Sarkom, retroperitonealer Keimzelltumor, Tuberkulose.
Therapie des Morbus Ormond
Akute Dekompression der Nieren:
nach retrograder Pyelographie ist die Einlage von DJ-Harnleiterschienen indiziert.
Medikamentöse Therapie:
Steroidtherapie mit Prednisolon 1 mg/kg KG/d für 2 Tage, dann Reduktion auf 40 mg, 20 mg, 10 mg im alle 2 Wochen, 5 mg Erhaltungsdosis für 1 Jahr (Brandt, Roth et al., 2013). Je nach Ansprechen und Verträglichkeit werden zusätzlich Immunsuppressiva wie Azathioprin und Mycophenolat-Mofetil (MMF) kombiniert. Auch mit Tamoxifen wurden Therapieerfolge berichtet. Bei Patienten mit aktiven Entzündungszeichen (BSG, Leukozytose) ist die Steroidtherapie besonders effektiv.
Sekundärer Morbus Ormond:
Diagnose und Therapie möglicher krankheitsauslösenden Ursachen, siehe oben unter bekannte Auslöser.
Operative Therapie des Morbus Ormond:
die operative Freilegung (Ureterolyse und intraperitoneale Verlagerung) ist indiziert bei Versagen der medikamentösen Therapie oder bei unklarer Diagnose nach Biopsie. Voraussetzung ist eine signifikante Nierenfunktion, funktionslose Nieren werden nephrektomiert.
Technik der Ureterolyse:
Präoperativ werden frische DJ-Harnleiterschienen eingelegt. Mediane Laparotomie, Inzision der parakolischen Rinne bds. und Verlagerung des Kolons auf beiden Seiten nach medial. Ausführliche Biopsien der retroperitonealen Fibrose und Einsendung als Schnellschnitt. Die Ureteren werden bds. freigelegt, am besten wird von distal nach proximal präpariert. Nach Freilegung der Ureteren werden sie nach intraperitoneal verlagert, das Peritoneum wird hinter den Ureteren wieder verschlossen. Bei massivem Befall kann Omentum majus um die Ureteren gelegt werden, damit eine sichere Trennung zur Fibrose gelingt. Vor allem proximal ist auf einen weiten Hiatus des Peritoneums zu achten. Alternativ können die Ureteren lateral retroperitoneal platziert werden.
Harnleiterersatz:
je nach Manifestation der Erkrankung und Befall des Ureters muss dieser segmental oder komplett ersetzt werden. Zur Anwendung kommen u.a. die Boari-Plastik, Ureterersatz durch Darmsegmente oder die autologe Nierentransplantation, siehe Ureterstriktur.
Nachsorge
Die retroperitoneale Fibrose ist eine chronisch-rezidivierende Erkrankung, lebenslange Nachsorgen sind notwendig (BSG, CRP, Sonographie der Nieren und ggf. CT/MRT alle 1–2 Jahre nach Absetzen der Immunsuppression).
| Ureterstriktur | Suchen | Ureteritis cystica |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur Morbus Ormond
Vaglio u.a. 2006 VAGLIO, A. ; SALVARANI, C. ; BUZIO, C.: Retroperitoneal fibrosis.In: Lancet
367 (2006), Nr. 9506, S. 241–51
 English Version: Ormond disease: retroperitoneal fibrosis
English Version: Ormond disease: retroperitoneal fibrosis