Sie sind hier: Startseite > Hoden > Infertilität > Therapie der Unfruchtbarkeit
Therapie der Unfruchtbarkeit des Mannes
- Infertilität des Mannes: Ursachen und Diagnose
- Unfruchtbarkeit des Mannes: Therapie
Beratung und Aufklärung bei Unfruchtbarkeit
Beratung und Aufklärung über Zeitpunkt und Frequenz des Geschlechtsverkehrs, allgemein wird GV alle 2–3 Tage empfohlen. Gleitmittel sollten möglichst nicht verwendet werden. Empfehlenswert ist eine gesunde Ernährung mit reichlich Antioxidantien, Vermeidung von regelmäßigem Alkoholkonsum, von exzessiver sportlicher Belastung, Rauchen, Drogen, Anabolika und Übergewicht (BMI über 30). Bei Frauen führt Untergewicht (unter 15% des Idealgewichts) zur sekundären Amennorrhoe und zur signifikanten Störung der Fruchtbarkeit.
Therapie von Hormonstörungen
Hypogonadotroper Hypogonadismus:
Therapie des Hypogonadismus mit HCG-Stimulation oder pulsatile GnRH-Therapie mit Hilfe einer Medikamentenpumpe. Die direkte Testosteronsubstitution ist durch die Hemmung der Gonadotropine (insbesondere FSH) kontraproduktiv.
Hyperprolaktinämie:
Bei einem Makroadenom der Hypophyse ist die transsphenoidale Hypophysentumorresektion indiziert. Ohne einen sichtbaren Hypophysentumor ist die Gabe von Bromocriptin (5–10 mg/Tag) und Kontrolle der Testosteron- und Prolaktinkonzentrationen notwendig.
Adrenogenitales Syndrom:
Schwere Infertilität (bis zur Azoospermie) und ein testikulärer adrenaler Resttumor (TART) sind bei unzureichender medikamentöser Therapie des adrenogenitalen Syndroms möglich. Eine korrekte (ausreichende) Substitution von Cortison und Fludrocortison ist für die Fruchtbarkeit der betroffenen Männer unerlässlich.
Therapie sexueller Funktionsstörungen:
Sexuelle Funktionsstörungen sind die am häufigsten behandelbaren Ursachen der Unfruchtbarkeit.
Vorzeitige Ejakulation:
Therapiekonzepte beinhalten lokale Lidocainsalben, Start-Stopp Techniken des GV, vorhergehende Masturbation, oder die medikamentöse Therapie mit Serotonin Re-uptake Inhibitoren (SSRI) wie Fluoxetin, Paroxetin oder Dapoxetin. Siehe Abschnitt vorzeitige Ejakulation.
Retrograde Ejakulation:
Versuch mit Sympathomimetika wie Imipramin 25–75 mg p.o. 1–1–1 oder Desimipramin 50 mg p.o. jeden zweiten Tag. Alternativ können Spermien aus dem postejakulatorischen Urin gewonnen werden.
Elektroejakulation:
Die Elektroejakulation ist indiziert bei Querschnittslähmung mit fehlender Ejakulation oder nach (chirurgischer) retroperitonealer Nervenverletzung. Die Elektrostimulation durch das Rektum stimuliert sympathische Nerven und führt zu einer Kontraktion der ableitenden Samenwege. Der antegrade Teil der Ejakulation wird direkt aufgefangen, der retrograde Anteil wird mit Hilfe eines Katheters entnommen.
Therapie entzündlicher Störungen der Fruchtbarkeit:
Die Studienlage bei entzündlicher Unfruchtbarkeit ist widersprüchlich und teilweise schlecht abgesichert.
Anti-Sperma Antikörper:
Aufgrund schlechter Datenlage für Glukokortikoide ist die ICSI Therapie der ersten Wahl. Alternativ Therapieversuch mit Glukokortikoiden in Kombination von IVF oder ICSI nach fehlgeschlagener In-vitro-Fertilisation.
Pyospermie:
Langzeitantibiose und häufige Ejakulationen können eine chronische Samenwegsinfektion zur Ausheilung bringen. Als Antibiotika sind Doxycyclin, Fluorchinolone, Erythromycin, Amoxicillin oder Cotrimoxazol (nach Kultur oder empirisch) geeignet. Als Therapieversuch ist auch die Kombination der Antibiotikatherapie mit nichtsteroidalen Antiphlogistika denkbar.
Empirische medikamentöse Therapie bei fehlender Ursache der Unfruchtbarkeit:
Bei der Mehrzahl der subfertilen Männer ist eine Ursache für ein grenzwertig pathologisches Spermiogramm (z. B. OAT-Syndrom) nicht eruierbar. Zahlreiche Substanzen werden empirisch bei der männlichen Unfruchtbarkeit oder Subfertilität angewendet. Die Kosten und möglichen Nebenwirkungen müssen bei eingeschränkt nachgewiesener Wirksamkeit immer mit der Option der künstlichen Befruchtung (IVS, ICSI) abgewogen werden.
Antioxidantien:
Mehrere randomisierte Studien haben den therapeutischen Effekt von Nahrungsergänzungsmittel mit antioxidativer Wirkung untersucht. In der Cochrane Metaanalyse wurde bei Männern mit Subfertilität eine erhöhte Schwangerschaftsrate (OR 3–4) nachgewiesen (Showell u.a., 2014). Prinzipiell kann auch durch eine gesunde Ernährung die Antioxidantienmenge erhöht werden. Kommerziell erhältliche Nahrungsergänzungsmittel mit antioxidativer Wirkung enthalten Glutathion, Vitamin E, Vitamin C, Carotinoide, Resveratrol, Flavonoide und Spurenelemente wie Zink oder Selen.
Östrogenantagonisten:
Tamoxifen und Clomifen führen zu einer Erhöhung der Gonadotropine und damit zu einer Stimulation der Spermiogenese. Eine Metaanalyse mehrerer randomisierter Studien fand eine 2,4fach Verbesserung der Schwangerschaftsrate (Chua u.a., 2013). Dosierung (Off-Label Anwendung) von Tamoxifen 10 mg 1–0–1.
Aromatasehemmer:
Die Hemmung der Aromatase senkt die Umwandlung von Testosteron in Östradiol und ist eine Therapieoption bei infertilen Männern mit niedriger Testosteron-Östradiol-Ratio. Dosierung (Off-Label Anwendung): Testolacton 50–100 mg 1-0-1, Letrozol 2,5 mg 1-0-0 oder Anastrozol 1 mg 1-0-0.
Rekombinantes FSH:
Therapieversuch mit signifikantem Effekt (OR 2–9) bei idiopathischer männlicher Infertilität in mehreren randomisierten Studien (Santi u.a., 2015). Dosierung (Off-Label Anwendung): 75–150 IU 3×/Woche.
Weitere Medikamente:
mit widersprüchlichen Daten zur Wirksamkeit: Kallikrein, Zinksalze, Pentoxifyllin, Mastzellblocker, L-Carnitin.
Varikozelenoperation:
Bei unerfülltem Kinderwunsch mit pathologischem Spermiogramm und Varikozele bessert die Varikozelenoperation mehrere Parameter des Spermiogramms. Die Varikozelektomie bessert mehrere Parameter des Spermiogramms. Die Metaanalyse von Marmar u.a. (2007) ergab eine 2,7-fache Erhöhung der Schwangerschaftsrate. Die Varikozelektomie reduziert die DNA-Fragmentierung der Spermien und verbessert die Ergebnisse der assistierten Fertilisation (Machen u.a., 2019). Bei nichtobstruktiver Azoospermie und Varikozele konnten einzelne Studien eine Verbesserung der Spermienextraktionsrate nach Varikozelenoperation nachweisen, bei 14% wurden postoperativ Spermien im Ejakulat nachgewiesen (Sajadi u.a., 2019). Weitere Studien sind notwendig.
Obstruktive Azoospermie:
Vor operativer Therapie sollte die intakte Spermienproduktion mit einer Hodenbiopsie bestätigt werden, am besten mit gleichzeitiger Kryokonservierung. Je nach Ursache der Obstruktion existieren folgende operative Therapieoptionen:
Vasovasostomie:
Die Vasovasostomie ist indiziert bei Obstruktion des Vas deferens nach Vasektomie. Exzision der Vasektomienarbe und der Striktur, Prüfung der Durchgängigkeit durch Kochsalzinjektion, Spermienmikroskopie aus dem distalen (dem Hoden zugewandten) Ende. Werden aus dem distalen Ende Spermatozoen nachgewiesen, wird eine Vasovasostomie durchgeführt [Abb. Technik der Vasovasostomie]. Bei negativem intraoperativem Spermiogramm sollte eine Vasoepididymostomie durchgeführt werden.
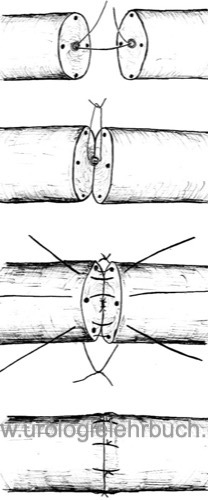 |
Die Vasographie während der operativen Therapie der Samenwegsobstruktion wurde aufgegeben, da das Kontrastmittel Strikturen der ableitenden Samenwege erzeugen kann.
Durchgängigkeitsraten von über 75 % und Schwangerschaftsraten von 46 bis 82 % werden berichtet. Prädiktoren für ein schlechteres Ergebnis: Schlechte operative Technik, negatives intraoperatives Spermiogramm, Vasektomie über 10 Jahre zurückliegend und hohe Antikörpertiter gegen Spermien.
Vasoepididymostomie:
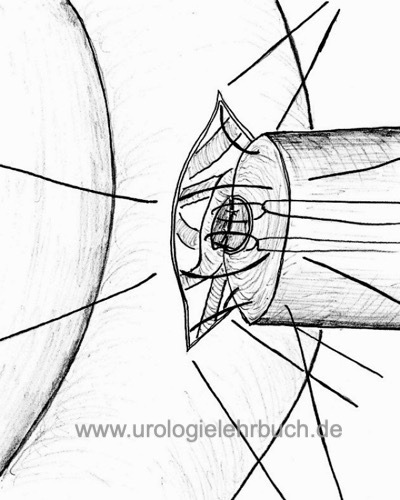
Die Vasoepididymostomie ist indiziert bei Obstruktion des Epididymis oder bei negativem intraoperativem Spermiogramm bei geplanter Vasovasostomie. Technik: Inzision der dilatierten Epididymis-Schlinge, motile Spermien werden kryokonserviert und eine Vasoepididymostomie (Seit-zu-End Anastomose) durchgeführt [Abb. Technik der Vasoepididymostomie]. Durchgängigkeitsraten zwischen 37 bis 85 % und Schwangerschaftsraten zwischen 13 bis 42 % werden publiziert.
 |
Obstruktion des Ductus ejaculatorius:
Sehr selten. Die Diagnose gelingt durch ein vermindertes Spermavolumen, Azoospermie und fehlende Fructose in der Samenflüssigkeit, gestaute Samenblasen und Ductus ejaculatorius in der TRUS. Ein Therapieversuch ist mit einer endoskopischen Rekanalisierung (TUR des Colliculus seminalis) möglich, alternativ operative Spermiengewinnung und ICSI.
Techniken der assistierten Reproduktion
Techniken der assistierten Reproduktion kommen zur Anwendung, wenn o.g. Therapieansätze versagen. Alle Therapieansätze beinhalten eine (operative) Spermiengewinnung mit Aufbereitung und Aufkonzentration, die hormonelle Stimulation der Frau zur kontrollierten Follikelreifung und dann verschiedene Techniken der Eibefruchtung.
Spermaaufbereitung für Kinderwunschbehandlung:
Für eine Insemination oder IVF müssen die Spermien vom Seminalplasma getrennt werden. Das Sperma wird nach Verflüssigung mit Kulturmedium versetzt und zentrifugiert, der Überstand wird verworfen und die Spermien mit Kulturmedium resuspendiert. Überschüssige Spermien können nun kryokonserviert werden. Die Aufkonzentrierung von beweglichen Spermien gelingt mit der sogenannten Swim-up Methode: das Sperma wird zentrifugiert, der Überstand verworfen und die Spermien werden vorsichtig mit Kulturmedium überschichtet. Nun können mobile Spermien in den Überstand schwimmen und werden gezielt abgesaugt.
Operative Spermiengewinnung:
Die operative Spermiengewinnung ist indiziert bei Azoospermie oder bei relevanter DNA-Fragmentierung der Spermatozoen.
Mikrochirurgische epididymale Spermienaspiration (MESA):
Die mikrochirurgische epididymale Spermienaspiration (MESA) ist die offen mikrochirurgische Inzision eines dilatierten Nebenhodentubulus, Aspiration der Flüssigkeit mit Spermien aus dem Nebenhoden, Kryokonservierung in Portionen, um mehrfache ICSI-Zyklen durchführbar zu machen. MESA ist indiziert bei obstruktiver Azoospermie, insbesondere wenn gleichzeitig eine operative Refertilisation (Vasoepididymostomie) durchgeführt wird.
Testikuläre Spermatozoenextraktion (TESE):
Hodengewebsentnahme und portionierte Kryokonservierung für mehrere ICSI-Zyklen. Sie indiziert bei Azoospermie oder bei relevanter DNA-Fragmentierung der Spermatozoen. Eine Entnahme von Hodengewebe an mehreren Lokalisationen mit mikrochirurgischer Identifizierung von dilatierten Tubuli sichert den höchsten Erfolg. Eine perkutane Biopsietechnik ist bei Patienten mit obstruktiver Azoospermie und normaler Spermatogenese möglich (pTESE).
Intrauterine Insemination:
Die intrauterine Insemination ist eine Therapieoption bei männlicher Subfertilität oder bei pathologischem Postkoitaltest. Die Gesamtanzahl der beweglichen Spermien (TMSC) nach Aufbereitung sollte über 5–10 Millionen liegen. Der Insemination geht die ovarielle Stimulation mit Gonadotropinen voraus, es besteht ein deutlich erhöhtes Risiko für Mehrlingsschwangerschaften. Die Erfolgschance pro Zyklus beträgt etwa 8–10% (Dickey u.a., Fertil Steril 1999) und ist stark vom Alter der Frau abhängig.
In vitro Fertilisation (IVF):
Mehrere 100000 aufbereitete mobile Spermien sind Minimum für die In vitro Fertilisation (IVF). Nach Gewinnung der Eizelle wird die Befruchtung in der Petrischale mit aufbereitetem Sperma durchgeführt. Nach Befruchtung der Eizellen in vitro werden die Zygoten bis zum Morula-Stadium kultiviert. Je nach Alter der Frau und anderen klinischen Faktoren werden 1–3 Morula in das Cavum uteri eingebracht.
Intracytoplasmatische Spermieninjektion (ICSI):
Die intracytoplasmatische Spermieninjektion (ICSI) benötigt nur wenige Spermatozoen (kryokonserviertes Sperma oder nach MESA oder TESE, siehe oben). Zunächst wird die Follikelreifung hormonell gesteuert und eine sonographisch gestützte transvaginale Punktion der Follikel zur Eizellengewinnung durchgeführt. Einzelne Spermien werden unter dem Mikroskop in mehrere Eizellen injiziert. Nach Befruchtung der Eizellen in vitro werden die Zygoten bis zum Morula-Stadium kultiviert. Je nach Alter der Frau und anderen klinischen Faktoren werden 1–3 Morula in das Cavum uteri eingebracht. ICSI führt (stark altersabhängig) in 30% der Zyklen zu einer Schwangerschaft und in 23% zu einer Lebendgeburt.
Komplikationen der künstlichen Befruchtung:
Die Hormonstimulierung der Frau zur gezielten Follikelreifung ist nebenwirkungsreich: Bauchschmerzen, Verletzungen bei der Entnahme, Hormonnebenwirkungen. Durch die Implantation von mehreren Morula sind Mehrlingsschwangerschaften möglich. Das Risiko kongenitaler Fehlbildungen wird durch assistierte Reproduktionstechniken verdoppelt. Schon aus dieser Tatsache heraus existieren ethische Bedenken gegen diese Technik. Die genetische Präimplantationsdiagnostik ermöglicht bei Erbkrankheiten die Selektion von gesunden Embryonen; diese Selektion und Vernichtung der erkrankten Embryonen ist ebenfalls stark umstritten.
| Ursachen der Infertilität | Suchen | Altershypogonadismus |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
H. Cuppens and J. J. Cassiman, “CFTR mutations and polymorphisms in male infertility,” Int J Androl, vol. 27, no. 5, pp. 251–6, 2004.
S. C. Esteves, M. Roque, C. K. Bradley, and N. Garrido, “Reproductive outcomes of testicular versus ejaculated sperm for intracytoplasmic sperm injection among men with high levels of DNA fragmentation in semen: systematic review and meta-analysis.,” Fertil Steril, vol. 108, no. 3, pp. 456–467, 2017.
Gurunath, S.; Pandian, Z.; Anderson, R. A. &
Bhattacharya, S.
Defining infertility--a systematic review of
prevalence studies.
Hum Reprod Update 2011, 17, 575-588
Gnoth, C.; Godehardt, E.; Frank-Herrmann, P.; Friol,
K.; Tigges, J. & Freundl, G.
Definition and prevalence of
subfertility and infertility.
Hum Reprod, 2005, 20,
1144-1147
G. Haidl, H. C. Schuppe, F. M. Köhn, and C. Leiber, “[Evidence-based drug therapy for male infertility],” Urologe A, vol. 47, no. 12, pp. 1555–6, 1558–60, 2008.
Hendry u.a. 2001 HENDRY, W. ; MEULEMAN, E. ;
POMEROL, J. ; PRYOR, B.:
Infertility: Urological Aspects.
In: Eur Urol
40/6 (2001)
J. L. Marmar et al., “Reassessing the value of varicocelectomy as a treatment for male subfertility with a new meta-analysis.,” Fertil Steril, vol. 88, no. 3, pp. 639–648, 2007.
J. Paick, S. H. Kim, and S. W. Kim, “Ejaculatory duct obstruction in infertile men,” BJU Int, vol. 85, no. 6, pp. 720–4, 2000.
W. Rodprasert, J. Toppari, and H. E. Virtanen, “Endocrine Disrupting Chemicals and Reproductive Health in Boys and Men.,” Front Endocrinol., vol. 12, p. 706532, 2021.
A. Salonia, S. Minhas, and C. Bettocchi, “EAU Guidelines: Sexual and Reproductive Health,” 2022. [Online]. Available: https://uroweb.org/guidelines/sexual-and-reproductive-health/.
D. Santi, A. R. M. Granata, and M. Simoni, “FSH treatment of male idiopathic infertility improves pregnancy rate: a meta-analysis.,” Endocr Connect, vol. 4, no. 3, pp. R46–R58, 2015.
P. Schlegel, M. Sigman, B. Collura, C. De Jonge, M. Eisenberg, and et al., “Diagnosis and Treatment of Infertility in Men: AUA/ ASRM Guideline.” [Online]. Available: https://www.auanet.org/guidelines-and-quality/guidelines/male-infertility
M. G. Showell, R. Mackenzie-Proctor, J. Brown, A. Yazdani, M. T. Stankiewicz, and R. J. Hart, “Antioxidants for male subfertility.,” Cochrane Database Syst Rev, vol. 12, p. CD007411, 2014.
 English Version: Treatment of male infertility
English Version: Treatment of male infertility