Sie sind hier: Startseite > Nieren > Nierenzellkarzinom > Chemotherapie
Behandlung des Nierenzellkarzinoms mit Metastasen
- Nierenzellkarzinom: Ursachen und Pathologie
- Nierenzellkarzinom: Klinik und Diagnose
- Nierenzellkarzinom: operative Therapie
- Nierenzellkarzinom: Therapie des metastasierten Nierenzellkarzinoms
Zusammenfassende Literatur: EAU Guidelines RCC. Deutsche S3-Leitlinie Nierenzellkarzinom.
Prognose des metastasierten Nierenzellkarzinoms (Motzer-Kriterien)
Im Rahmen von randomisierten Studien wurden Kriterien für die Prognose des metastasierten Nierenzellkarzinoms erarbeitet. Häufig verwendet wurde der Score von Motzer aus dem MSKCC (Motzer u.a., 2002), dieser basiert auf Studien der Immuntherapie, siehe Tab. Motzer-Kriterien. Der IMDC-Score ist eine Aktualisierung und beeinhaltet Patientendaten aus modernen Studien mit Kinasenhemmern und Checkpoint-Inhibitoren (Heng u.a., 2013), siehe Tab.IMDC-Score für die Kriterien und die Überlebenszeit der Risikogruppen.
| Risikofaktor | Grenzwert |
| niedriger Karnofsky-Index | < 80 % |
| hohe LDH | > 1,5fache der Norm |
| niedriges Hb | < unterer Normwert |
| hohes korrigiertes Kalzium | > 10 mg/dl oder 2,4 mmol/l |
| Zeit von Diagnose bis systemische Therapie | < 1 Jahr |
| Risikofaktor | Grenzwert |
| niedriger Karnofsky-Index | < 80 % |
| erhöhte neutrophile Granulozyten | > oberer Normwert |
| erhöhte Thrombozyten | > oberer Normwert |
| Niedriges Hb | < unterer Normwert |
| hohes korrigiertes Kalzium | >10 mg/dl oder 2,4 mmol/l |
| Zeit von Diagnose bis systemische Therapie | < 1 Jahr |
Operative Therapie von Primärtumor und Metastasen:
Wenn eine komplette Resektion aller Metastasen und des Primärtumor möglich ist, sollte die operative Therapie ohne neoadjuvante Therapie durchgeführt werden. Je nach Lokalisation der Metastasen (Lunge, Leber, Knochen) sind entsprechende chirurgische Disziplinen zu konsultieren. Trotz vollständiger Resektion aller sichtbarer Läsionen besteht ein hohes Rezidivrisiko, die operative Therapie kann jedoch die Notwendigkeit der medikamentösen Therapie verzögern und bessert wahrscheinlich auch die Prognose der Patienten. Weitere Vorteile der chirurgischen Therapie der Metastasen sind die Palliation von lokalen Beschwerden.
Die Prognose nach Entfernung einer solitären Metastase ist bei Patienten ungünstiger, bei denen die Metastase schon bei Erstdiagnose bestand. Wenn die Metastase erst in der Tumornachsorge entdeckt wird, ist die Zeit von der Erstdiagnose bis zur Metastasenentstehung prognostisch entscheidend.
Zytoreduktive Tumornephrektomie
Die zytoreduktive Tumornephrektomie ist die Entfernung des Primärtumors vor einer medikamentösen Therapie der Metastasen, welche nicht entfernt werden können. Neben der Palliation von lokalen Beschwerden führt die Tumornephrektomie vor geplanter Immuntherapie zu einer Verlängerung des Überlebens bei einem Nierenzellkarzinom (Mikisch u.a., 2001). Die laparoskopische zytoreduktive Tumornephrektomie bietet aufgrund kürzerer Rekonvaleszenzzeit Vorteile im metastasierten Stadium, da die Zeit bis zur Immuntherapie gesenkt werden kann.
Für die zytoreduktive Tumornephrektomie vor Therapie mit Inhibitoren der Signaltransduktion wurden zwei randomisierte Studien durchgeführt (CARMENA und SURTIME). Beide Studien konnten keine Vorteile für die zytoreduktive Nephrektomie vor Sunitinib nachweisen (Mejean u.a., 2018) (Bex u.a., 2019), es wurden allerdings nur Patienten mit mittlerem oder hohem Risiko eingeschlossen.
Die zytoreduktive Nephrektomie wird in der aktuellen EAU-Leitlinie nur bei Patienten mit einem geringen Metastasenvolumen und großen Primärtumor empfohlen. Bei gutem Ansprechen der systemischen Therapie kann die verzögerte zytoreduktive Nephrektomie erwogen werden. Keine Indikation zur zytoreduktiven Tumornephrektomie besteht bei Patienten mit hohem Risiko, kleinem Primärtumor und hoher Metastasenlast, bei schlechtem Ductus-Bellini-Karzinomen oder sarkomatoiden Nierentumoren, falls die Histologie vor Operation bekannt ist.
Immuncheckpoint Inhibitoren zur Therapie des metastasierten Nierenzellkarzinoms
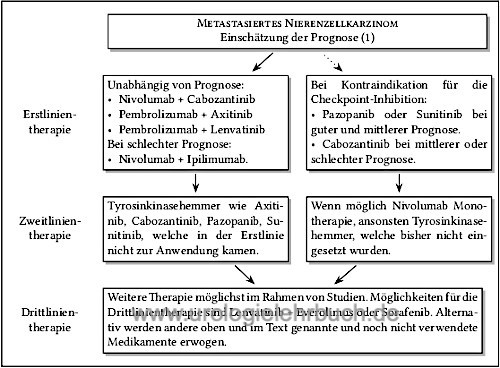 |
Die Aktivierung von Immun-Checkpoint Rezeptoren führt zur Hemmung und Schwächung der zellulären Immunreaktion. Sie haben ihre physiologische Funktion in der Vermeidung von Autoimmunerkrankungen. Verschiedene Rezeptoren wurden identifiziert: PD-1-Rezeptor (PD für programmed cell death) oder CTLA-4 (CTLA für cytotoxic T lymphocyte antigen) auf T-Lymphozyten mit entsprechende Liganden wie PD-L1. Tumoren nutzen o.g. Wege um eine Immuntoleranz zu induzieren. Siehe Pharmakologie und Nebenwirkungen der Checkpoint-Inhibitoren (CPI).
Im mehreren Studien konnte die Überlegenheit der kombinierten Therapie (Tyrosinkinasehemmer mit Immuncheckpoint-Inhibitor) gegenüber der Monotherapie nachgewiesen werden. Die Therapie führt bis zu 10% zu einer kompletten Remission und häufig zu einem deutlichen Ansprechen, teilweise tritt der Therapieeffekt verzögert ein. Die Nebenwirkungen sind erheblich ( 15% Grad 3–4, 1,5% therapiebedinge Todesfälle). Nur bei eindeutigem Progress oder nicht tolerierbaren Nebenwirkungen (trotz Therapie und Dosisreduktion) folgt ein Wechsel zur nächsten Therapieoption [Abb. sequentielle Therapie des metastasierten Nierenzellkarzinoms].
Avelumab kombiniert mit Axitinib:
Avelumab kombiniert mit Axitinib verbesserte in einer Phase III Studie im Vergleich zu Sunitinib das progressionsfreie Überleben (14 vs. 7 Monate) und die Ansprechrate (CR 4% vs. 2%, PR 49% vs. 25%), Daten für das Überleben wurden noch nicht publiziert (Motzer u.a., 2019), der Nutzen war unabhängig von der IMDC-Risikoeinteilung.
Nivolumab Monotherapie:
Nivolumab verbesserte als Zweitlinientherapie das Gesamtüberleben gegen Everolimus (25 vs. 20 Monate) und zeigte dabei weniger Nebenwirkungen (Motzer u.a., 2015). Pharmakologie und Nebenwirkungen siehe Abschnitt Nivolumab.
Nivolumab kombiniert mit Ipilimumab:
Nivolumab kombiniert mit Ipilimumab zeigte in der CheckMate-214 Studie gegenüber Sunitinib in der Erstlinientherapie bei Patienten mit mittlerer und schlechter Prognose Vorteile im progressionsfreien Überleben sowie im Gesamtüberleben (56 vs. 38 Monate nach 5 Jahren Nachbeobachtung). Die Kombination zeigt auch ein gutes Ansprechen bei sarkomatoidem Nierenzellkarzinom (Albiges u.a., 2020).
Nivolumab kombiniert mit Cabozantinib:
In der CheckMate-9ER Studie verbessertes progressionsfreies Überleben (17 vs. 8 Monate, HR 0,51), Gesamtansprechen (56% vs. 27%), komplette Remission (8% vs. 5%) und Gesamtüberleben (HR 0,60) im Vergleich zu Sunitinib, der Vorteil war in allen Risikogruppen nachweisbar (Choueiri u.a., 2021a).
Pembrolizumab kombiniert mit Axitinib:
Pembrolizumab kombiniert mit Axitinib verbesserte in einer Phase III Studie im Vergleich zu Sunitinib das progressionsfreie Überleben, die Ansprechrate (CR 6% vs. 2%, PR 53% vs. 34%) und das Gesamtüberleben (HR 0,59, 1JÜR 90% vs. 79%) (Rini u.a., 2019), dies war unabhängig von der IMDC-Risikoeinteilung oder der PD-L1-Epression.
Inhibition der Signaltransduktion zur Behandlung von Metastasen des Nierenzellkarzinoms
Die gezielte Therapie mit Hemmern der Signaltransduktion ("smart drugs" oder "targeted therapy") verdrängte die Immuntherapie mit Interferon oder Interleukin und hatte sich vor der Etablierung der Immuncheckpoint-Inhibition als neuer Standard etabliert. Sie werden aktuell in Kombination mit Hemmer der Immuncheckpoints verabreicht (siehe oben), oder als Monotherapie, wenn die CPI kontraindiziert sind. Die Inhibitoren der Signaltransduktion erzeugen eine stabile Erkrankung, eine komplette Remission ist sehr selten zu beobachten. Günstige Verlaufsparameter unter Therapie sind größenregrediente oder größenstabile Metastasen, welche im Vergleich zur Ausgangsuntersuchung hypoperfundiert sind.
Das Nebenwirkungsprofil der Substanzen ist günstiger als eine Immuntherapie oder die Kombinationsbehandlung mit Immuncheckpoint-Inhibitoren (siehe oben). Es wird eine sequentielle Therapie der "smart drugs" empfohlen, wobei jede Substanz so lange als möglich eingesetzt werden soll. Nur bei eindeutigem Progress oder nicht tolerierbaren Nebenwirkungen (trotz Therapie und Dosisreduktion) folgt ein Wechsel zum nächsten Präparat [Abb. sequentielle Therapie des metastasierten Nierenzellkarzinoms].
Axitinib:
Axitinib ist ein potenter Inhibitor der VEGF-Rezeptor-Tyrosinkinase. Axitinib ist für die Zweitlinientherapie der Nierenzellkarzinom-Metastasen nach Versagen mit Zytokinen oder Smart-Drugs zugelassen. Im Vergleich zu Sorafenib war in der Zulassungstudie das progressionsfreie Überleben mit 6,7 vs. 4,7 Monate verlängert (Rini u.a., 2011). Neue Bedeutung hat Axitinib in der Erstlinientherapie als Kombinationsbehandlung mit Pembrolizumab oder Avelumab erhalten, siehe oben. Siehe Dosierung, Pharmakologie und Nebenwirkungen von Axitinib.
Bevacizumab:
ist ein monoklonaler Antikörper gegen VEGF, zugelassen für die Erstlinientherapie des metastasierten Nierenzellkarzinoms. In Kombination mit Interferon zeigt Bevacizumab eine Verlängerung des progressionsfreien Überlebens von 10,2 vs. 5,4 Monaten im Vergleich zu einer alleinigen Interferontherapie (Escudier u.a., 2007) (Motzer und Bukowski, 2006). Siehe auch Pharmakologie, Dosierung und Nebenwirkungen von Bevacizumab.
Cabozantinib:
Cabozantinib ist ein oraler Inhibitor von Tyrosinkinasen wie MET, VEGF und AXL. Cabozantinib ist zugelassen für die Zweit- und Drittlinientherapie des metastasierten Nierenzellkarzinom. Im Vergleich zu Everolimus war das progressionsfreie Überleben (7,4 vs. 3,8 Monate) und das Gesamtüberleben (21 vs. 19 Monate) verlängert (Choueiri u.a., 2015). Cabozantinib zeigte auch bei der Erstlinientherapie gegenüber Sunitinib eine höhere progressionsfreie Überlebensrate (9 vs. 5 Monate) bei Patienten mit mittlerem und hohem Risiko (Choueiri u.a., 2018), so dass auch eine Zulassung für die Erstlinientherapie von Patienten mit mittleren und ungünstigen Risiko ausgesprochen wurde. Siehe Dosierung, Pharmakologie und Nebenwirkungen von Cabozantinib.
Inhibition von mTOR:
Everolimus und Temsirolimus sind Inhibitoren von mTOR (mammalian Target of Rapamycin), einem zentralen Molekül der intrazellulären Signaltransduktion von Zellwachstum, Angiogenese, Energiehaushalt und Apoptose (Faivre u.a., 2006). Everolimus ist zugelassen bei Progress unter Therapie mit Inhibitoren der Signaltransduktion, hier zeigte sich im Vergleich mit Placebo eine geringe Verbesserung (5 vs. 2 Monate) des progressionsfreien Überleben (Motzer u.a., 2008). Everolimus und Temsirolimus haben nur noch eine Bedeutung für die Drittlinientherapie. Dosierung, Pharmakologie und Nebenwirkungen von Everolimus und Pharmakologie, Dosierung und Nebenwirkungen von Temsirolimus.
Lenvatinib (in Kombination mit Everolimus):
Lenvatinib ist ein Multikinasehemmer gegen die VEGF-Rezeptorkinasen, FGFR-Rezeptorkinasen, PDGF-Rezeptorkinasen sowie c-KIT. Lenvatinib verlängert in Kombination mit Everolimus das progressionsfreie Überleben (14,6 vs. 5,5 Monate) im Vergleich zur Everolimus-Monotherapie bei Patienten nach Versagen der Erstlinientherapie (Motzer u.a., 2015a). Lenvatinib wurde ohne Vorliegen einer Phase III Studie zugelassen. Die Kombination führt zu einer erhöhten Nebenwirkungsrate (Grad 3–4 von 70%).
Pazopanib:
Pazopanib ist ein Tyrosinkinaseinhibitor (VEGF-Rezeptor, PDGF-Rezeptor und Tyrosinkinase c-kit) mit Zulassung für die Erst- und Zweitlinientherapie (Sternberg u.a., 2010). Das progressionsfreie Überleben verbesserte sich signifikant (9,2 vs. 4,2 Monate), in der Subgruppe ohne Vortherapie war der Unterschied noch deutlicher (11,1 vs. 2,8 Monate). Für das Gesamtüberleben konnten keine signifikanten Unterschiede nachgewiesen werden. Pharmakologie, Dosierung und Nebenwirkungen von Pazopanib.
Sorafenib:
Sorafenib ist ein oraler Multikinasehemmer, der in die intrazellulären Signaltransduktionskaskaden von Zellwachstum und der Angiogenese eingreift. Zu diesen Kinasen gehören die RAF Kinase, VEGF-Rezeptorkinasen, PDGF-Rezeptorkinase, KIT und FLT-3 (Escudier u.a., 2007a). Sorafenib ist eine Therapieoption nach Versagen der Erst- und Zweitlinientherapie. In der Zulassungsstudie zeigte sich ein verbessertes progressionsfreies und Gesamtüberleben nach Versagen der Zytokintherapie (Escudier u.a., 2009). Der direkte Vergleich mit Sunitinib in der Erst- und Zweitlinientherapie (SWITCH1) zeigte keine signifikanten Unterschiede in der Sequenz Sorafenib-Sunitinib vs. Sunitinib-Sorafenib (Eichelberg u.a., 2015). Pharmakologie, Dosierung und Nebenwirkungen von Sorafenib.
Sunitinib:
Sunitinib ist ein oraler Multikinasehemmer, insbesondere von Tyrosinkinasen, z. B. VEGF- und PDGF-Rezeptorkinasen. Randomisierte Studien zeigten ein verbessertes progressionsfreies Überleben von 11 vs. 5 Monaten im Vergleich zur Immuntherapie mit Interferon, das Gesamtüberleben war mit 26 vs. 22 Monaten nicht signifikant besser (Motzer u.a., 2007). Pharmakologie, Dosierung und Nebenwirkungen von Sunitinib.
Tivozanib:
Tivozanib ist ein Tyrosinkinaseninhibitor der VEGF-Rezeptorkinase. In einer randomisierten Studie wurde Tivozanib gegen Sorafenib getestet, es zeigte sich eine Verbesserung des progressionsfreien Überlebens (12 vs. 9 Monate) bei besserer Verträglichkeit (Motzer u.a., 2013). In der Zulassungsstudie konnte eine Verbesserung des Gesamtüberlebens nicht nachgewiesen werden. Tivozanib ist eine Therapieoption für die Erstlinientherapie bei Patienten mit niedrigem oder intermediärem Risiko.
Immuntherapie des metastasierten Nierenzellkarzinoms:
Die Gabe von Interferon-α mit Kombination von Interleukin-2 und 5-FU führt in bis zu 40 % zu einer partiellen Remission bei selektionierten Patienten. Es gibt jedoch auch einige randomisierte Studien mit weit geringerer Wirkung und ohne Effekt auf das Überleben (Negrier u.a., 2007). Das Ansprechen unter der Immuntherapie ist ein starker positiver prognostischer Faktor. Die Therapiekosten als auch die Nebenwirkungsrate der Immuntherapie sind sehr hoch (Mancuso und Sternberg, 2005). Eine geringere Nebenwirkungsrate hat die Immuntherapie mit Interferon-α s. c. als Monotherapie, die Ansprechraten sind jedoch auch geringer. Seit der Verfügbarkeit von Inhibitoren der Signaltransduktion wird die Immuntherapie (ohne Bevacizumab) nur noch selten angewendet.
Chemotherapie des metastasierten Nierenzellkarzinoms:
Folgende Chemotherapiekombinationen wurden mit moderater Aktivität getestet: Gemcitabine und 5-FU, Gemcitabine mit Immuntherapie. Kein Schema konnte sich in der klinischen Praxis durchsetzen.
Palliative Therapie des metastasierten Nierenzellkarzinoms:
Schmerzhafte Knochenmetastasen:
Optimierung der Schmerztherapie. Zusätzliche Therapieooptionen sind Bestrahlung, Bisphosphonate (Zoledronat), Denosumab und/oder chirurgische Stabilisierung.
Hyperkalziämie:
Bei Hyperkalziämie helfen höher dosierte Kortikoide, forcierte Diurese, NaCl-Infusion oder Bisphosphonate.
Tumorschmerzen, Tumorblutung:
palliative Tumornephrektomie oder Embolisation.Hirnmetastasen:
Gabe von Kortikosteroiden, je nach Ausmaß stereotaktische Strahlentherapie oder Ganzhirnbestrahlung.
Prognose des Nierenzellkarzinoms
Wachstum des Primärtumors:
Am Anfang Tumorwachstum mit durchschnittlich 3–5 mm/Jahr. Viele kleine Tumoren wachsen gar nicht. Eine Metastasierung durch Tumoren unter 3 cm Durchmesser ist selten.
Lokales Tumorstadium:
Für die Prognose in Abhängigkeit des klinischen Tumorstadiums siehe Tab. Prognose und klinisches Stadium. Genauere Ergebnisse für die Überlebenswahrscheinlichkeit sind durch die Berücksichtigung von mehreren Risikofaktoren möglich, siehe Stage, Size, Grade, and Necrosis (SSIGN) Score [Tab. SSIGN Score 1 und SSIGN Score 2].
Grading:
Prognose des Nierenzellkarzinoms in Abhängigkeit des Gradings: G1 (89 % 5JÜR), G2 (65 % 5JÜR), G3 (46 % 5JÜR).
Prognose des Nierenzellkarzinoms mit Lymphknotenmetastasen:
5JÜR 5–30 %.Prognose des Nierenzellkarzinoms mit Veneninvasion:
knapp 40 % der Patienten mit Veneninvasion sind pN0 und M0. 26 % haben Lymphknotenmetastasen. 54 % haben Fernmetastasen. Bei Patienten mit pN0 M0 ist die 5JÜR um 70 %.
Prognose des Nierenzellkarzinoms mit systemischen Metastasen:
Das metastasierte Nierenzellkarzinom ist eine sehr aggressive Krankheit. Patienten mit Metastasen zum Zeitpunkt der Erstdiagnose haben eine schlechte Prognose und sterben normalerweise innerhalb des ersten Jahres. Das Intervall von der Erstdiagnose bis zum Einsetzen der Metastasen ist prognostisch entscheidend, da es über die Progressionsgeschwindigkeit der systemischen Erkrankung informiert. Pulmonale Metastasen haben die beste Prognose. Neben Metastasen in anderer Lokalisation zeigen folgende Faktoren eine schlechte Prognose an: niedriger Karnofsky-Index, Anämie, abnormes korrigiertes Serumkalzium, hohe LDH, hohe AP, erhöhte Thrombozyten und erhöhte neutrophile Granulozyten. Siehe Tab. IMDC Score für die mittlere Überlebenszeit unter moderner Therapie mit Inhibitoren der Signaltransduktion.
Prognose des Nierenzellkarzinoms mit Hirnmetastasen:
Mediane Überlebenszeit von 7 Monaten, prognostische Faktoren sind der Karnofsky-Index und die Anzahl der Metastasen.
| Nierenzellkarzinom 3/4 | Suchen | Wilms-Tumor |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur Nierenzellkarzinom
L. Albiges, N. M. Tannir, M. Burotto, D. McDermott, E. R. Plimack, and R. J. Motzer, “Nivolumab plus ipilimumab versus sunitinib for first-line treatment of advanced renal cell carcinoma: extended 4-year follow-up of the phase III CheckMate 214 trial.,” ESMO open, vol. 5, no. 6, p. e001079, 2020.
Choueiri, T. K.; Escudier, B.; Powles, T.; Mainwaring,
P. N.; Rini, B. I.; Donskov, F.; Hammers, H.; Hutson, T. E.; Lee, J.-L.;
Peltola, K.; Roth, B. J.; Bjarnason, G. A.; Géczi, L.; Keam, B.; Maroto,
P.; Heng, D. Y. C.; Schmidinger, M.; Kantoff, P. W.; Borgman-Hagey, A.;
Hessel, C.; Scheffold, C.; Schwab, G. M.; Tannir, N. M.; Motzer, R. J. & ,
M. E. T. E. O. R. I.
Cabozantinib versus Everolimus in Advanced
Renal-Cell Carcinoma.
N Engl J Med, 2015, 373,
1814-1823.
DGU; DKG; DKG & Leitlinienprogramm Onkologie Diagnostik, Therapie und Nachsorge des Nierenzellkarzinoms, Langversion 4.02023 https://www.leitlinienprogramm-onkologie.de/leitlinien/nierenzellkarzinom/.
Escudier u.a. 2007 ESCUDIER, Bernard ; EISEN,
Tim ; STADLER, Walter M. ; SZCZYLIK, Cezary ;
OUDARD, Stéphane ; SIEBELS, Michael ; NEGRIER,
Sylvie ; CHEVREAU, Christine ; SOLSKA, Ewa ;
DESAI, Apurva A. ; ROLLAND, Frédéric ; DEMKOW,
Tomasz ; HUTSON, Thomas E. ; GORE, Martin ;
FREEMAN, Scott ; SCHWARTZ, Brian ; SHAN, Minghua ;
SIMANTOV, Ronit ; BUKOWSKI, Ronald M. ; GROUP, T.
A. R. G. E. T. S.:
Sorafenib in advanced clear-cell renal-cell carcinoma.
In: N Engl J Med
356 (2007), Jan, Nr. 2, S. 125–134
B. Escudier, T. K. Choueiri, S. Oudard, C. Szczylik, S. Negrier, A. Ravaud,
C. Chevreau, P. Venner, P. Champagne, D. Croteau, E. Dupont, C. Hariton, and
R. M. Bukowski.
Prognostic factors of metastatic renal cell carcinoma after failure
of immunotherapy: new paradigm from a large phase iii trial with shark
cartilage extract ae 941.
J Urol, 178 (5): 1901–1905, Nov 2007.
doi: rm10.1016/j.juro.2007.07.035.
URL https://dx.doi.org/10.1016/j.juro.2007.07.035.
B. Escudier, A. Pluzanska, P. Koralewski, A. Ravaud, S. Bracarda, C. Szczylik,
C. Chevreau, M. Filipek, B. Melichar, E. Bajetta, V. Gorbunova, J. O. Bay,
I. Bodrogi, A. Jagiello-Gruszfeld, und N. Moore.
Bevacizumab plus interferon alfa-2a for treatment of metastatic renal
cell carcinoma: a randomised, double-blind phase iii trial.
Lancet, 370 (9605): 2103–2111, Dec 2007.
S. Faivre, G. Kroemer, and E. Raymond.
Current development of mtor inhibitors as anticancer agents.
Nat Rev Drug Discov, 5 (8): 671–688, Aug
2006.
doi: rm10.1038/nrd2062.
URL https://dx.doi.org/10.1038/nrd2062.
Frank u.a. 2003 FRANK, I. ; BLUTE, M. L. ;
CHEVILLE, J. C. ; LOHSE, C. M. ; WEAVER, A. L. ;
LEIBOVICH, B. C. ; ZINCKE, H.:
A multifactorial postoperative surveillance model for patients with
surgically treated clear cell renal cell carcinoma.
In: J Urol
170 (2003), Nr. 6 Pt 1, S. 2225–32
Gold u.a. 1996 GOLD, P. J. ; FEFER, A. ;
THOMPSON, J. A.:
Paraneoplastic manifestations of renal cell carcinoma.
In: Semin Urol Oncol
14 (1996), Nr. 4, S. 216–22
Heng, D. Y. C.; Wells, J. C.; Rini, B. I.; Beuselinck,
B.; Lee, J.-L.; Knox, J. J.; Bjarnason, G. A.; Pal, S. K.;
Kollmannsberger, C. K.; Yuasa, T.; Srinivas, S.; Donskov, F.; Bamias, A.;
Wood, L. A.; Ernst, D. S.; Agarwal, N.; Vaishampayan, U. N.; Rha, S. Y.;
Kim, J. J. & Choueiri, T. K.
Cytoreductive nephrectomy in patients
with synchronous metastases from renal cell carcinoma: results from the
international metastatic renal cell carcinoma database consortium.
Eur Urol 2014,
66, 704-710.
G. Hudes, M. Carducci, P. Tomczak, J. Dutcher, R. Figlin, A. Kapoor,
E. Staroslawska, J. Sosman, D. McDermott, I. Bodrogi, Z. Kovacevic,
V. Lesovoy, I. G. H. Schmidt-Wolf, O. Barbarash, E. Gokmen, T. O’Toole,
S. Lustgarten, L. Moore, R. J. Motzer, and G. A. Trial.
Temsirolimus, interferon alfa, or both for advanced renal-cell
carcinoma.
N Engl J Med, 356 (22): 2271–2281, May 2007.
Kattan u.a. 2001 KATTAN, M. W. ; REUTER, V. ;
MOTZER, R. J. ; KATZ, J. ; RUSSO, P.:
A postoperative prognostic nomogram for renal cell carcinoma.
In: J Urol
166 (2001), Nr. 1, S. 63–7
Rana R. McKay u.a.
Impact of angiotensin system inhibitors (ASI) on outcomes in patients (pts) with metastatic renal cell carcinoma (mRCC): Results from a pooled clinical trials database. J Clin Oncol 32, 2014 (suppl 4; abstr 437).
B. C. Leibovich, M. L. Blute, J. C. Cheville, C. M. Lohse, I. Frank, E. D.
Kwon, A. L. Weaver, A. S. Parker, und H. Zincke.
Prediction of progression after radical nephrectomy for patients with
clear cell renal cell carcinoma: a stratification tool for prospective
clinical trials.
Cancer, 97 (7): 1663–1671, Apr 2003.
doi: rm10.1002/cncr.11234.
URL https://dx.doi.org/10.1002/cncr.11234.
Ljungberg, B.; Albiges, L.; Bensalah, K.; Bex, A.;
Giles, R.; Hora, M.; Kuczyk, M.; Lam, T.; L.Marconi; Merseburger, A.;
Powles, T.; Staehler, M. & Volpe, A.
EAU Guidelines on Renal Cell Carcinoma
2018. https://uroweb.org/guidelines/renal-cell-carcinoma/
Mancuso und Sternberg 2005 MANCUSO, A. ;
STERNBERG, C. N.:
What’s new in the treatment of metastatic kidney cancer?
In: BJU Int
95 (2005), Nr. 9, S. 1171–80
Mickisch, G. H.; Garin, A.; van Poppel, H.; de Prijck,
L.; Sylvester, R.; , E. O. f. R. & of Cancer (EORTC) Genitourinary Group,
T.
Radical nephrectomy plus interferon-alfa-based immunotherapy
compared with interferon alfa alone in metastatic renal-cell carcinoma: a
randomised trial.
Lancet, 2001, 358, 966-970.
Motzer und Bukowski 2006 MOTZER, Robert J. ;
BUKOWSKI, Ronald M.:
Targeted therapy for metastatic renal cell carcinoma.
In: J Clin Oncol
24 (2006), Dec, Nr. 35, S. 5601–5608. -
URL https://dx.doi.org/10.1200/JCO.2006.08.5415
Motzer u.a. 2007 MOTZER, Robert J. ; HUTSON,
Thomas E. ; TOMCZAK, Piotr ; MICHAELSON, M. D. ;
BUKOWSKI, Ronald M. ; RIXE, Olivier ; OUDARD,
Stéphane ; NEGRIER, Sylvie ; SZCZYLIK, Cezary ;
KIM, Sindy T. ; CHEN, Isan ; BYCOTT, Paul W. ;
BAUM, Charles M. ; FIGLIN, Robert A.:
Sunitinib versus interferon alfa in metastatic renal-cell carcinoma.
In: N Engl J Med
356 (2007), Jan, Nr. 2, S. 115–124. -
URL https://dx.doi.org/10.1056/NEJMoa065044
Motzer, R. J.; Escudier, B.; McDermott, D. F.; George,
S.; Hammers, H. J.; Srinivas, S.; Tykodi, S. S.; Sosman, J. A.; Procopio,
G.; Plimack, E. R.; Castellano, D.; Choueiri, T. K.; Gurney, H.; Donskov,
F.; Bono, P.; Wagstaff, J.; Gauler, T. C.; Ueda, T.; Tomita, Y.; Schutz,
F. A.; Kollmannsberger, C.; Larkin, J.; Ravaud, A.; Simon, J. S.; Xu,
L.-A.; Waxman, I. M.; Sharma, P. & CheckMate025
Nivolumab versus
Everolimus in Advanced Renal-Cell Carcinoma.
New Engl J Med 2015, 373,
1803-1813.
Motzer, R. J.; Hutson, T. E.; Glen, H.;
Michaelson, M. D.; Molina, A.; Eisen, T.; Jassem, J.; Zolnierek, J.;
Maroto, J. P.; Mellado, B.; Melichar, B.; Tomasek, J.; Kremer, A.; Kim,
H.-J.; Wood, K.; Dutcus, C. & Larkin, J.
Lenvatinib, everolimus,
and the combination in patients with metastatic renal cell carcinoma: a
randomised, phase 2, open-label, multicentre trial.
The Lancet.
Oncology, 2015a, 16, 1473-1482.
R. J. Motzer, B. Escudier, S. Oudard, T. E. Hutson, C. Porta, S. Bracarda,
V. Gruenwald, J. A. Thompson, R. A. Figlin, N. Hollaender, G. Urbanowitz,
W. J. Berg, A. Kay, D. Lebwohl, und A. Ravaud.
Efficacy of everolimus in advanced renal cell carcinoma: a
double-blind, randomised, placebo-controlled phase iii trial.
Lancet, Jul 2008.
R. J. Motzer et al.“Tivozanib versus sorafenib as initial targeted therapy for patients with metastatic renal cell carcinoma: results from a phase III trial.,” Journal of clinical oncology : official journal of the American Society of Clinical Oncology, vol. 31, no. 30, pp. 3791–3799, 2013.
S. Negrier, D. Perol, A. Ravaud, C. Chevreau, J. O. Bay, R. Delva, E. Sevin,
A. Caty, und B. Escudier.
Medroxyprogesterone, interferon alfa-2a, interleukin 2, or
combination of both cytokines in patients with metastatic renal carcinoma of
intermediate prognosis: results of a randomized controlled trial.
Cancer, 110 (11): 2468–2477, Dec 2007.
Powles, T.; Albiges, L.; Staehler, M.; Bensalah,
K.; Dabestani, S.; Giles, R. H.; Hofmann, F.; Hora, M.; Kuczyk, M. A.;
Lam, T. B.; Marconi, L.; Merseburger, A. S.; Fernández-Pello, S.; Tahbaz,
R.; Volpe, A.; Ljungberg, B. & Bex, A.
Updated European Association
of Urology Guidelines Recommendations for the Treatment of First-line
Metastatic Clear Cell Renal Cancer.
European urology, 2017
Rini, B. I.; Escudier, B.; Tomczak, P.; Kaprin, A.;
Szczylik, C.; Hutson, T. E.; Michaelson, M. D.; Gorbunova, V. A.; Gore, M.
E.; Rusakov, I. G.; Negrier, S.; Ou, Y.; Castellano, D.; Lim, H. Y.;
Uemura, H.; Tarazi, J.; Cella, D.; Chen, C.; Rosbrook, B.; Kim, S. &
Motzer, R. J.
Comparative effectiveness of axitinib versus sorafenib in
advanced renal cell carcinoma (AXIS): a randomised phase 3 trial.
Lancet,
2011, 378, 1931-1939.
Sternberg, C. N.; Davis, I. D.; Mardiak, J.; Szczylik,
C.; Lee, E.; Wagstaff, J.; Barrios, C. H.; Salman, P.; Gladkov, O. A.;
Kavina, A.; Zarbá, J. J.; Chen, M.; McCann, L.; Pandite, L.; Roychowdhury,
D. F. & Hawkins, R. E.
Pazopanib in locally advanced or metastatic
renal cell carcinoma: results of a randomized phase III trial.
2010,
28, 1061-1068.
Weight, C. J.; Larson, B. T.; Fergany, A. F.; Gao, T.; Lane, B. R.; Campbell, S. C.; Kaouk, J. H.; Klein, E. A. & Novick, A. C.
Nephrectomy induced chronic renal insufficiency is associated with increased risk of
cardiovascular death and death from any cause in patients with localized
cT1b renal masses.
J Urol, 2010, 183, 1317-1323
Zini, L.; Perrotte, P.; Capitanio, U.; Jeldres, C.; Shariat, S. F.; Antebi, E.; Saad, F.; Patard, J.; Montorsi, F. &
Karakiewicz, P. I.
Radical versus partial nephrectomy: effect on
overall and noncancer mortality.
Cancer, 2009, 115,
1465-1471
Zisman u.a. 2002 ZISMAN, A. ; PANTUCK, A. J. ;
WIEDER, J. ; CHAO, D. H. ; DOREY, F. ;
SAID, J. W. ; DEKERNION, J. B. ; FIGLIN, R. A. ;
BELLDEGRUN, A. S.:
Risk group assessment and clinical outcome algorithm to predict the
natural history of patients with surgically resected renal cell carcinoma.
In: J Clin Oncol
20 (2002), Nr. 23, S. 4559–66
 English Version: renal cell carcinoma: treatment of advanced disease
English Version: renal cell carcinoma: treatment of advanced disease