Sie sind hier: Startseite > Hoden > Anatomie > Sexualhormone
Funktion und Steuerung der männlichen Sexualhormone (Testosteron)
- Anatomie des Hodens: Makroskopie Hoden, Nebenhoden, Samenstrang
- Histologie des Hodens und Spermatogenese
- Physiologie, Sexualhormone Testosteron, LH, RH, GnRH
Die sexuelle Differenzierung zum männlichen Geschlecht
Das chromosomale Geschlecht:
Das normale Karyogramm besteht aus 46 Chromosomen, 22 Autosomenpaaren und 2 Geschlechtschromosomen (Gonosomen). Das weibliche Geschlecht wird durch zwei X-Geschlechtschromosomen bestimmt, das männliche Geschlecht durch ein X- und einem Y-Geschlechtschromosom. Die chromosomale Konstellation induziert die Entwicklung eines Ovars oder Hodens aus der undifferenzierten Gonade. Das Vorhandenseins eines Y-Chromosoms oder der verantwortlichen Region des Y-Chromosoms (testis-determinierender Faktor) führt zur Entwicklung eines Hodens.
Der Testis-determinierender Faktor (TDF) ist das Gen SRY, es kodiert ein Protein aus 80 Aminosäuren, das an die DNA bindet und die Transkription der Gene für die sexuelle Differenzierung bewirkt (WT1, SF1, SOX). Ohne die Anwesenheit des Testis-determinierenden Faktor entwickelt sich die undifferenzierte Gonade in ein Ovar. Bei zwei X-Chromosomen (oder mehr) wird ein X-Chromosom inaktiviert, es entsteht Heterochromatin, das im Lichtmikroskop als Barr-Körperchen sichtbar wird. Diese Inaktivierung und Verpackung des überschüssigen X-Chromosoms wird durch das Gen XIST kodiert.
Embryologie des Hodens:
Die Einzelheiten der Entwicklung des Hodens und der männlichen Geschlechtsorgane siehe Kapitel Embryologie des Urogenitaltraktes. Fehlen funktionsfähige Hoden entwickelt sich trotz männlicher Geschlechtschromosomen (46, XY) ein weibliches Genital. Dies gilt auch für Defekte des Androgenrezeptors, fehlende Umwandlung von Testosteron in Dihydrotestosteron (DHT) oder fehlende oder fehlerhafte Bildung des Anti-Müller-Hormons (AMH).
Die psychosexuelle Differenzierung:
Die frühere Annahme, dass die psychische sexuelle Identifizierung durch Erziehung und körperliche Vergleiche erfolgt, ist falsch. Männliche Patienten (46, XY) mit Intersex-Störung aufgrund von Enzymdefekten entwickeln häufig Zweifel an ihrer zugewiesenen weiblichen Geschlechtsrolle. Embryonale Androgenexposition und (unbekannte) Gene auf dem Y-Gen führen zu einer frühen Geschlechtsprägung.
Pubertät:
Die Pubertät führt zu einer Aktivierung der Hypothalamus-Hypophysen-Gonaden-Achse mit Reifung der Gonaden, Genitalien und sekundären Geschlechtsmerkmale. Ein zuverlässiges Zeichen für den Beginn der Pubertät bei Jungen ist ein Hodenvolumen von mehr als 3 ml bei einem mittleren Alter von 11,9 Jahren (10--13,7 Jahre +/- 2 SD). Innerhalb eines Jahres nach Beginn der Pubertät treten die Pubarche (Schambehaarung) und Spermarche (Spermiennachweis) auf. Die Dauer der Pubertät beträgt etwa 3,5 Jahre, das endgültige Hodenvolumen wird mit 15,3 Jahren erreicht (Harms, 2018).
Funktion und Regulation der Sexualhormone: GnRH, LH, FSH und Testosteron
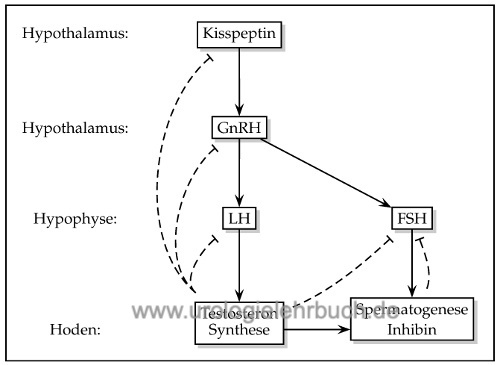
Die Hypothalamus-Hypophysen-Gonaden Hormonachse steuert die Freisetzung der Sexualhormone [Abb. Steuerung der Sexualhormone]. Die Sexualhormone spielen eine entscheidende Rolle bei der Ausbildung des Geschlechtsphänotyps, der sexuellen Reifung während der Pubertät, der endokrinen Funktion der Hoden und der Spermatogenese.
 |
Hypothalamus und Sexualhormone:
Der Hypothalamus besitzt Neurone, welche das Gonadotropin-Releasing Hormon (GnRH, Gonadoliberin oder veraltet LHRH) produzieren und pulsatil (alle 90–120 min) über ihre Axone freisetzen. GnRH ist ein Peptidhormon aus 10 Aminosäuren und stimuliert in der Hypophyse die Freisetzung von LH und FSH (s.u.). Wichtige Aktivatoren der GnRH-Freisetzung zu Beginn der Pubertät und danach sind die Peptidhormone Kisspeptin und Neurokinin B, die von entsprechenden Neuronen des Hypothalamus gebildet werden (Tassigny u.a., 2010) (Topalogl u.a., 2009). Die Peptidhormone veranlassen über spezifische G-Proteinrezeptoren die Freisetzung von GnRH. Zahlreiche Hormone (Sexualsteroide, Dopamin, FSH, LH, Opioide und wahrscheinlich auch Inhibin) hemmen die GnRH-Ausschüttung im Sinne einer negativen Rückkopplung.
Hypophyse und Sexualhormone:
GnRH gelangt über den Portalvenenkreislauf in die Hypophyse und stimuliert dort die Freisetzung der Peptidhormone LH (luteinisierendes Hormon) und FSH (follikelstimulierendes Hormon). LH (28 kDa) und FSH (33 kDa) sind Glykoproteine, die aus einer α- und β-Kette bestehen. Die α-Kette gleicht den anderen Hypophysenhormonen, die β-Kette vermittelt die biologische Wirkung. Die LH-Sekretion folgt der pulsatilen GnRH-Sekretion, die FSH-Sekretion ist durch den Einfluss von Inhibin und der längeren Halbwertszeit komplexer. LH bewirkt die Testosteronsynthese im Hoden, FSH ist der entscheidende Stimulus für die Spermatogenese. Die Freisetzung von LH und FSH wird durch Testosteron und Inhibin gehemmt.
Hoden und Sexualhormone:
Beide Grundfunktionen des Hodens, sowohl die endokrine Funktion (Testosteron, Inhibin...) als auch die exokrine Funktion (Spermatogenese) werden von der Hypothalamus-Hypophysen-Gonaden-Hormonachse gesteuert.
Testosteron:
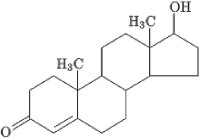
Zur chemischen Struktur des Steroidhormons Testosteron siehe Abb. Strukturformel von Testosteron. Die Biosynthese von Testosteron wird im Kapitel Funktion der Steroidhormone dargestellt. Nur 1–3 % des Gesamttestosterons sind im Plasma ungebunden (freies Testosteron). 60% des Testosterons sind an Sexualhormon-bindendes Globulin (SHBG) gebunden, der Rest ist albumingebunden. Als bioverfügbares Testosteron wird das freie und das albumingebundene Testosteron genannt, da beide biologische Aktivität entfalten können. Die höchste Testosteronkonzentration im Serum wird morgens gemessen, der Normalwert liegt altersabhängig zwischen 12–35 nmol/l (3,5–10 ng/ml). Abends sind die Konzentrationen um 40 % niedriger.
Testosteron wird im Zielorgan häufig durch die 5α-Reduktase in Dihydrotestosteron (DHT) umgewandelt. DHT hat eine höhere Bindungsaffinität zum Androgenrezeptor und ist daher lokal das stärkere Androgen im Vergleich zu Testosteron.
Die Aromatase bewirkt in peripheren Geweben die Umwandlung von Testosteron zu Östradiol. Im Sinne einer negativen Rückkopplung hemmen Testosteron und Östradiol die Freisetzung von LH und FSH in der Hypophyse sowie von GnRH im Hypothalamus.
 |
Androgenrezeptor:
Der Androgenrezeptor ist ein nukleärer Proteinrezeptorkomplex, der aus einer DNA-bindenden und einer Liganden-bindenden Region besteht. Der Androgenrezeptor ist eng mit dem Glukokortikoidrezeptor verwandt. Die Bindung von Androgenen an den Androgenrezeptor führt zu einer verstärkten Transkription spezifischer Gene, welche die Hauptwirkung der Androgene vermitteln. Kurzfristige Androgeneffekte werden durch den Androgenrezeptor über intrazelluläre Proteinkinasen und die Kalziumkonzentration vermittelt (Culig u.a., 2003).
Inhibin:
Inhibin ist ein 32 kDa Protein, das von Sertoli-Zellen gebildet wird und spezifisch die Freisetzung von FSH in der Hypophyse hemmt. Umgekehrt wird die Freisetzung von Inhibin durch FSH stimuliert.
Activin:
Activin ist ein Proteinhormon mit Homologie zu TGF-beta, wird von Sertoli-Zellen gebildet und stimuliert als Antagonist von Inhibin die Freisetzung von FSH in der Hypophyse. Activin und seine Rezeptoren kommen auch in anderen Organen vor, wo Activin ein multifunktionelles Regulatorprotein mit einem breiten Spektrum biologischer Funktionen ist.
Spermatogenese:
Die Anwesenheit von FSH im Hoden ist entscheidend für das Wachstum der Tubuli seminiferi während der Pubertät. Die Bindung von FSH an die Sertolizellen bewirkt die Produktion einer Reihe von Mediatoren, die die Spermatogenese stimulieren: Androgen-bindendes Protein, Transferrin, Laktat, Ceruloplasmin, Clusterin, Plasminogenaktivator, Prostaglandine und Wachstumsfaktoren.
Funktion der Sexualhormone:
Sexualhormone spielen eine entscheidende Rolle bei der Ausbildung des Geschlechtsphänotyps, der Geschlechtsreifung in der Pubertät, der endokrinen Funktion der Hoden und der Spermatogenese (s. o.).
Außerhalb der Geschlechtsorgane steuert Testosteron das Wachstum der Körper- und Barthaare, nicht jedoch der Kopfhaare. Es hat eine anabole Wirkung (Muskeln, Knochen, Knorpel). Darüber hinaus steuert Testosteron das Verhalten (Libido, Antrieb, Ausdauer und Aggression) und beeinflusst die Blutbildung (Erythropoetin und Wirkung auf Blutstammzellen) und die Leber.
| Spermatogenese | Suchen | Nebennieren |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Benninghoff 1993 BENNINGHOFF, A.:
Makroskopische Anatomie, Embryologie und Histologie des
Menschen.
15. Auflage.
München; Wien; Baltimore : Urban und Schwarzenberg, 1993
Culig u.a. 2003 CULIG, Z. ; KLOCKER, H. ;
BARTSCH, G. ; STEINER, H. ; HOBISCH, A.:
Androgen receptors in prostate cancer.
In: J Urol
170 (2003), Nr. 4 Pt 1, S. 1363–9
D'Anglemont de Tassigny, X. & Colledge, W. H.
The role of kisspeptin signaling in reproduction.
Physiology
(Bethesda), 2010, 25, 207-217.
 English Version: physiology of the testes and male androgens: biochemistry and regulation of testosterone
English Version: physiology of the testes and male androgens: biochemistry and regulation of testosterone
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.