Sie sind hier: Startseite > Diagnostik > Spermiogramm
Spermiogramm (Ejakulatanalyse): Durchführung und Auswertung
Ein Spermiogramm ist bei unerfülltem Kinderwunsch (Infertilität) zur Planung der Kinderwunschbehandlung indiziert. Das Spermiogramm ist kein zuverlässiger Test für die Bestimmung der Fruchtbarkeit: Mann kann mit einem schlechtem Spermiogramm Vater werden, mit einem guten Spermiogramm ist trotzdem keine Vaterschaft garantiert. Eine verfrühte andrologische Diagnostik kann bei ungeduldigen Paaren zu einer gewissen Überdramatisierung mit der Gefahr einer Übertherapie führen. Die Infertilität wird als das Ausbleiben einer Schwangerschaft trotz regelmäßigem ungeschützten Geschlechtsverkehr über 1 oder 2 Jahre definiert. Die Methodik und Normwerte folgen den Empfehlungen des Handbuchs der WHO von 2010.
Technische Durchführung der Ejakulatanalyse
Ein vollständiges Auffangen des Samens ist elementar für eine korrekte Analyse eines Spermiogramms. Eine sexuelle Karenz von mindestens zwei Tagen wird vor der Untersuchung empfohlen.
Nach der Samengewinnung sollte das frische Sperma im Brutschrank bei 37 Grad Celsius gelagert werden. Nach 30–60 min wird die Konsistenz und das Aussehen des Spermas erfasst, nach kompletter Verflüssigung werden Volumen und pH-Wert gemessen. In einer ersten mikroskopischen Untersuchung werden die Morphologie und Mobilität der Spermatozoen beurteilt und die Verdünnung für die Spermienzählung festgelegt. Nach der Verdünnung des Spermas und der Auszählung der Spermatozoen können Ausstrichpräparate für die Färbung angefertigt werden. Die WHO empfiehlt die Papanicolaou-, die Shorr- und die Diff-Quick-Färbung. In Abhängigkeit der erhobenen Befunde und klinischen Angaben werden Spezialuntersuchungen veranlasst (Vitalitätsprüfung, Entzündungsdiagnostik, immunologische Untersuchungen, Messung der Fruktose) oder ggf. eine Kryokonservierung durchgeführt.
Normalbefunde und Differentialdiagnose des Spermiogramms
Aussehen des Spermas:
Unmittelbar nach der Ejakulation hat der Samen i.d.R. eine halbfeste geronnene Konsistenz. Das Sperma verflüssigt sich innerhalb weniger Minuten bei Raumtemperatur oder im Brutschrank, einzelne Klumpen können länger bestehen bleiben und die Analyse erschweren. Normales flüssiges Sperma hat eine homogene, grau-trübe Farbe. Es ist transparenter, wenn die Spermien-Konzentration sehr gering ist. Manche Krankheiten führen zu einer Farbänderung: rot bis braun (Hämatospermie) oder gelb (Ikterus, Einnahme von Vitaminen oder Medikamente).
Konsistenz des Spermas:
Normal ist eine Verflüssigung des Spermas in maximal 60 min, danach beträgt die Fadenlänge des herabfallenden Tropfen von der Pipettenspitze unter 2 cm. Unzureichend liquifiziertes Sperma kann das weitere Spermiogramm verfälschen, durch wiederholtes Pipettieren soll das Sperma homogenisiert und durchmischt werden.
Volumen des Spermas:
Normales Spermavolumen: > 1,5 ml. Die WHO empfiehlt die Volumenbestimmung durch Wiegen des Auffanggefäßes vor und nach Samengewinnung, als Spermadichte soll 1 g/ml angenommen werden.
Ursachen für eine Hypospermie (vermindertes Volumen) sind die Untersuchungsbedingungen, unvollständige Gewinnung, retrograde Ejakulation, zentrale Obstruktion (Utriculuszysten, Fehlanlage der Samenblasen), Hypogonadismus.
pH-Wert des Spermas:
Der normale pH-Wert des Spermas beträgt 7,2–8,0. Für die pH-Bestimmung soll das Sperma zuvor gemischt werden (Pipette), der Messbereich des pH-Papiers soll zwischen pH 6–10 liegen.
Ein pH-Wert <7,2 (bei Azoospermie und reduziertem Volumen) zeigt ausschließlich Prostatasekret und damit die Obstruktion oder Fehlbildung der Samenwege an. Ein pH-Wert >8,0 kann durch eine Infektion der Samenwege entstehen.
Mikroskopische Untersuchung des Nativpräparates:
Ein gut durchmischter Tropfen des Spermas (10 μl) wird auf einem Objektträger unter einem Deckglass (22×22 mm) mit 200–400facher Vergrößerung beurteilt.
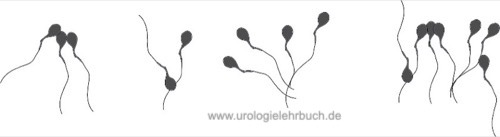
Agglutination:
Als Agglutination wird die Verklebung motiler Spermatozoen bezeichnet [Abb. Agglutination von Spermatozoen].
Die Agglutination von Spermatozoen spricht für die Existenz von Anti-Spermatozoen-Antikörper. Die Agglutination ist von einer unspezifischen Adhärenz immobiler Spermatozoen aneinander oder motiler Spermatozoen an Epithelzellen oder Debris zu trennen. Das Ausmaß und die Art der Agglutinierung sind nach folgender Graduierung zu beurteilen:
- Grad 1 (isoliert): <10 Spermatozoen per Agglutinat, viele freie Spermatozoen
- Grad 2 (moderat): Agglutinate mit 10–50 Spermatozoen, viele freie Spermatozoen
- Grad 3 (stark): Agglutinate mit >50 Spermatozoen, wenig freie Spermatozoen
- Grad 4 (komplett): Spermatozoen komplett agglutiniert, keine freie Spermatozoen sichtbar
Weitere Zellen:
Das Ejakulat kann neben Spermatozoen und Epithelzellen auch Rundzellen enthalten (DD Leukozyten oder unreife Spermatozoen). Die weitere Differenzierung der Rundzellen gelingt mit der Anfärbung der Peroxidase-positiven Zellen (Leukozyten) und erneuten Mikroskopie, es sollten weniger als 1 Million Leukozyten nachweisbar sein.
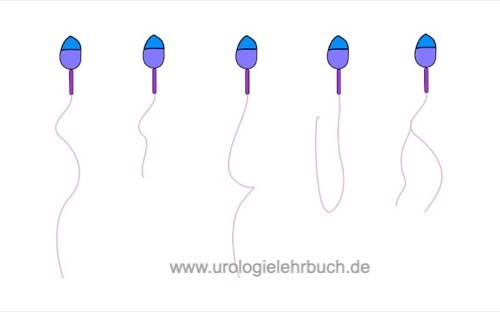
Beurteilung der Motilität von Samenzellen:
Die Motilität der Spermien sollte am besten direkt nach der Verflüssigung des Spermas beurteilt werden. Die Dicke der Flüssigkeitsschicht zwischen Objektträger und Deckglas sollte 20 μm betragen, dazu wird ein gut durchmischter Tropfen des Spermas (10 μl) auf einen Objektträger unter einem Deckglass (22×22 mm) mit 200–400facher Vergrößerung beurteilt. 200 Spermatozoen werden hinsichtlich der Motilität beurteilt und klassifiziert:
- Progressive Motilität (PR): aktive lineare oder leicht gekrümmte Vorwärtsbewegung des Spermatozoons.
- Nicht-progressive Motilität (NP): keine Vorwärtsbewegung oder Vorwärtsbewegung in engen Kreisen.
- Immotilität (IM): keine sichtbare Bewegung.
Es sollten mindestens zweimal 200 Spermatozoen auf zwei Objektträger nach o.g. Technik ausgezählt werden, die Ergebnisse sollten vergleichbar sein. Die Ergebnisse beider Untersuchungen werden gemittelt und in Prozent angegeben. Untere Grenzwerte für die Motilität: 40% motile Spermien (PR + NP), weiterhin mindestens 32% progressive Motilität.
Ein Anteil von weniger als 32% progressiv motiler Spermien wird als Asthenozoospermie definiert. Ursachen für eine Asthenozoospermie sind Viskosipathien (fehlende Verflüssigung), Autoantikörper, Entzündungen, morphologisch veränderte Spermatozoenschwänze. Ursachen für eine falsch-negative Immobilität sind nicht frisches Sperma, Kälte, Seifenrückstände oder die Verwendung von Kondomen.
Beurteilung der Vitalität:
Bei über 40% immobiler Spermien sollte eine Vitalitätsprüfung mit einer Eosin-Färbung durchgeführt werden, tote Spermien nehmen den Farbstoff innerhalb einer Minute auf. In der Mikroskopie zeigt sich dann eine Rotfärbung der Spermienköpfe, ungefärbte Spermien gelten als vital. Für die Untersuchung sollten 200 Spermien klassifiziert werden, der Normwert für vitale Spermien beträgt >58%. Als interne Kontrolle sollte der Anteil toter Spermien nicht über dem Anteil der immobilen Spermien liegen. Ein Anteil toter Spermien über 42% (Nekrozoospermie) ist ein Hinweis auf Infektionen der Samenwege, Hormonstörungen, Chemotherapie oder lange Perioden der sexuellen Enthaltsamkeit.
Anzahl der Samenzellen:
Die Spermatozoenanzahl (total sperm count) korreliert mit der Zeit bis zur Schwangerschaft (time to pregnancy) und mit der Schwangerschaftsrate. Nach Bestimmung der Spermatozoenkonzentration im Hämozytometer (es sollen zweimal 200 Spermatozoen ausgezählt werden), wird mit Hilfe des Samenvolumens die Spermatozoenanzahl ausgerechnet. Normwert: >39×106 Spermatozoen absolut.
Oligozoospermie:
<15×106 pro ml oder <39×106 Spermatozoen absolut.
Azoospermie:
Fehlender Nachweis von Spermien: Eine Azoospermie darf nur nach Zentrifugation des Ejakulats und Beurteilung des Sediments diagnostiziert werden.
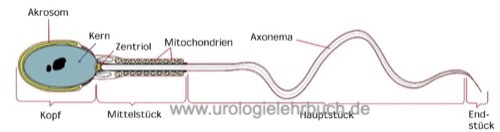
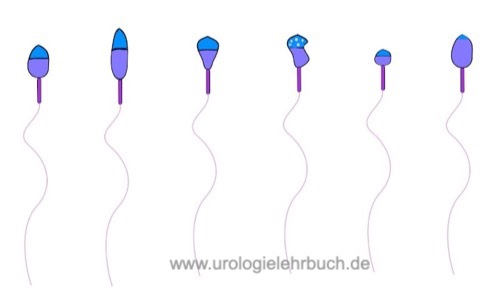
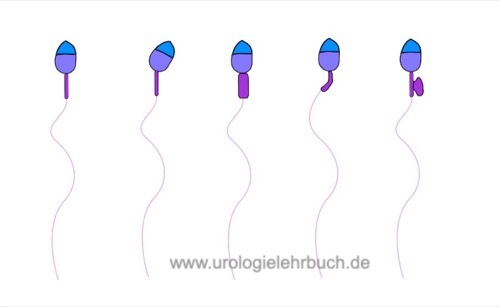
Morphologie der Samenzellen:
Die Morphologie der Spermatozoen wird bei 1000facher Vergrößerung nach Färbung von getrockneten Ausstrichpräparaten des Spermas beurteilt. Kriterien für die Klassifikation von normaler und pathologischer Morphologie siehe Abb. Kopfdefekte, Mittelstückdefekte und Hauptstückdefekte.
Morphologisch normale Spermatozoen in über 25% sind selten. Eine Teratozoospermie (verminderter Anteil normal konfigurierter Spermien) liegt bei weniger als 4% normaler Spermatozoen vor. Fakultativ kann die Lokalisation des Defektes mit angegeben werden: % Kopfdefekte, % Mittelstückdefekte, % Hauptstückdefekte und % Spermien mit exzessiven Zytoplasma.
Globozoospermie: seltene schwere Störung der Spermienmorphologie mit rundem Kopf und fehlendem Akrosom. Meist sind über die Hälfe der Spermien von der Störung betroffen, die Patienten sind unfruchtbar, die einzige therapeutische Option ist ICSI.
Entzündungsdiagnostik:
Hinweise auf eine Infektion der Samenwege liefern zahlreiche sichtbare Leukozyten im gefärbten Ausstrichpräparat [Abb. Pyospermie], die Bestimmung der Peroxidase-positiven Zellen im Spermiogramm (normal <1 × 106 Zellen pro ml), die Elastasekonzentration (normal <250 ng/ml), eine positive Spermienkultur und der Keimnachweis in der 4 Gläser-Probe (Probe 3 oder 4). Die Bedeutung der Entzündungsdiagnostik wird kontrovers diskutiert.
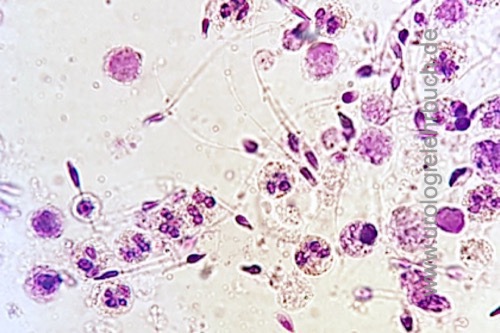 |
Pyospermie:
Die Pyospermie ist definiert als >106 Leukozyten/ml Ejakulat. Eine Harnwegsinfektion sollte ausgeschlossen sein. Der Nachweis von >103 Bakterien/ml Ejakulat spricht für eine signifikante Bakteriospermie.
Immunologische Untersuchungen:
Hinweis für Spermatozoenantikörper ist die Agglutination von Spermatozoen im Nativpräparat (s.o.) und ist eine Indikation für weitere immunologische Untersuchungen. Spermatozoenantikörper (Anti-sperm antibodies, ASA) können durch immunologische Nachweise wie den MAR-Test (Mixed-antiglobulin-reaction Test) oder den Immunobeads-Test nachgewiesen werden. Ausführliche Darstellung der Technik siehe aktuelles Manual der WHO, 2010. Der Test ist pathologisch, wenn mehr als 50% der beweglichen Spermien MAR-positiv sind. Die diagnostische Bedeutung des MAR-Tests ist umstritten, zumal auch wirksame therapeutische Optionen fehlen.
Fruktose im Sperma:
Die normale Fruktosekonzentration im Sperma beträgt >13 mmol/l im Seminalplasma (Überstand nach Zentrifugation des flüssigen Spermas). Erniedrigte Fruktosewerte im Spermiogramm sind bei Verschluss der ableitenden Samenwege zu erwarten.
Qualitätssicherung:
Die Bestimmung der Spermienkonzentration, Spermienmotilität und Spermienmorphologie unterliegt internen und externen Qualitätskontrollen gemäß den Vorgaben der Rili-BÄK.
| Karyogramm | Suchen | Ultraschall |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
World Health Organisation
Cooper, T. G. (ed.)
WHO laboratory manual for the examination and processing of human semen
WHO
Press, Geneva, Switzerland, 2010
 English Version: semen analysis
English Version: semen analysis
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.