Sie sind hier: Startseite > Prostata > Prostatakarzinom > Diagnose, Staging
Prostatakarzinom: Bildgebung, Diagnostik, Staging
- Prostatakarzinom: Definition, Epidemiologie und Ursachen
- Prostatakarzinom: Pathologie
- Prostatakarzinom: Klinik, Vorsorgeuntersuchung, PSA
- Prostatakarzinom: Diagnose, Bildgebung, Staging
- Prostatakarzinom: Therapieübersicht, aktive Überwachung
- Prostatakarzinom: Operation
- Prostatakarzinom: Therapie (Strahlentherapie)
- Prostatakarzinom: Therapie (Brachytherapie, Kryotherapie, HIFU)
- Prostatakarzinom: kastrationssensibles Prostatakarzinom
- Prostatakarzinom: kastrationsresistentes Prostatakarzinom, Prävention
Zusammenfassende Literatur und Leitlinien: EAU Guidelines Prostate Cancer, S3-Leitlinie Prostatakarzinom, Campbell-Walsh Urology (2015).
Staging des stanzbioptisch gesichertem Prostatakarzinoms
Von entscheidender Wichtigkeit für die Therapieentscheidung ist sowohl die Einschätzung des Tumorstadiums als auch die Einschätzung der biologischen Aggressivität des PCA. Diagnostisch kommen die rektale Untersuchung, Tumormarker, die Histologie der Stanzbiopsie, Laboruntersuchungen, bildgebende Verfahren und (sehr selten) die pelvine Lymphadenektomie zum Einsatz.
Klinisches Staging des Prostatakarzinoms
Die DRU, die PSA-Konzentration und der Differenzierungsgrad nach Gleason besitzen jeder für sich eine gute Korrelation mit dem pathologischen Tumorstadium. Für den einzelnen Tumorpatienten ist diese Vorhersagegenauigkeit jedoch zu gering. Mit der Kombination von o.g. Variablen kann jedoch das klinische Risiko (Prostatakarzinom-Mortalität) gut eingeschätzt werden [Tab. Risikostratifikation des PCA nach d’Amico].
| Risiko | Kriterien | 10-Jahres-Mortalität nach EBRT (*) | 10-Jahres-Risiko PSA-Progress n. RPE | 10-Jahres-Mortalität nach RRP (*) |
| Niedrig | PSA <10 ng/ml und Gleasonsumme ≤6 | 2% | 17% | 1% |
| Mittel | PSA 10–20 ng/ml oder Gleasonsumme=7 | 8% | 54% | 4% |
| Hoch | PSA >20 ng/ml oder Gleasonsumme >7 | 24% | 71% | 11% |
Ein weiterer wichtiger Risikofaktor ist die PSA-Velocity in dem Jahr vor Therapie, ungünstig ist ein Anstieg von über 2 ng/ml (D'Amico u.a., 2006). Mit der zusätzlichen Beachtung der Tumorlast in der Stanzbiopsie und anderer klinischer Parameter wird die Vorhersagegenauigkeit noch besser, hierfür ist der CAPRA-Score geeignet [Tab. CAPRA-Score]. CAPRA steht für Cancer of the Prostate Risk Assessment und wurde von der University of California, San Francisco basierend auf den Daten der CaPSURE-Studie entwickelt (Cooperberg u.a., 2009). Die pathologischen Ergebnisse und Prognose nach radikaler Prostatektomie in Abhängigkeit des CAPRA-Score zeigt Tab. Prognose nach RRP in Abhängigkeit des CAPRA-Scores.
| Risikofaktor | Kriterien | Punkte |
| Alter | < 50 Jahre | 0 |
| > 50 Jahre | 1 | |
| PSA | < 6 ng/ml | 0 |
| 6,1–10 ng/ml | 1 | |
| 10,1–20 ng/ml | 2 | |
| 20,1–30 ng/ml | 3 | |
| > 30 ng/ml | 4 | |
| > 30 ng/ml | 4 | |
| Gleason-Score der Biopsie | Kein Typ 4 oder 5 | 0 |
| Sekundärtyp 4 oder 5 | 1 | |
| Primärtyp 4 oder 5 | 3 | |
| Klinisches Stadium | T1–2 | 0 |
| ≥ T3a | 1 | |
| Anzahl der positiven Stanzbiopsien | < 34% | 0 |
| > 34% | 1 |
| CAPRA-Score | 0–1 | 2 | 3 | 4 | 5 | 6 | >7 |
| Positiver Schnittrand | 8–24 | 15–26 | 16–31 | 18–42 | 26–44 | 44–53 | 42–58 |
| Extrakapsuläre Ausdehnung | 6–14 | 16–19 | 23–26 | 26–40 | 44–55 | 51–56 | 68–86 |
| Samenblaseninfiltration | 1–2 | 3–4 | 4–6 | 9–11 | 13–21 | 22 | 27–47 |
| Lymphknotenmetastasen | 0–1 | 1–3 | 2 | 1–4 | 3–11 | 4–11 | 3–34 |
| 3 Jahre ohne Progression | 92–95 | 84–95 | 76–87 | 73–82 | 67–70 | 46–72 | 35–50 |
| 5 Jahre ohne Progression | 86–91 | 75–91 | 65–83 | 60–74 | 52–61 | 29–62 | 20–30 |
Die Partin-Tabellen verwenden die Kombination von lokalem Tumorstadium, PSA-Konzentration und Gleason-Summe. Als Ergebnis erhält der Untersucher das Risiko für extraprostatisches Wachstum, Samenblaseninfiltration und Lymphknotenmetastasierung. Manche Autoren vertreten die Meinung, dass die Partin-Tabellen das Risiko an Lymphknotenmetastasen unterschätzen. Ursache sei das zu kleine Dissektionsfeld der Lymphadenektomie in den klinischen Serien.
Das Kattan-Nomogramm verwendet ebenfalls die Kombination von lokalem Tumorstadium, PSA-Konzentration und Gleason-Summe. Als Ergebnis des Nomogramms erhält der Untersucher jedoch die 5-Jahres progressionsfreie Überlebensrate nach radikaler Prostatektomie (Kattan u.a., 1998). Kattan-Nomogramme sind inzwischen auch für die Vorhersage des progressionsfreien Überlebens nach Strahlentherapie (Kattan u.a., 2003) und Brachytherapie bei Prostatakarzinom (Kattan u.a., 2001) erhältlich, sowie für die MÜZ unter Hormontherapie im metastasierten Stadium (Smaletz u.a., 2002).
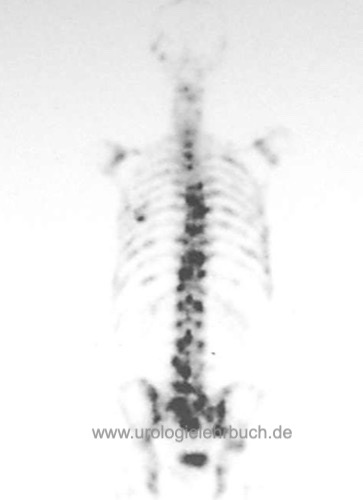
Knochenszintigramm
Das Knochenszintigramm dient als Screeningmethode für Knochenmetastasen des Prostatakarzinoms mit relativ hoher Sensitivität, aber geringer Spezifität [Abb. 2.6]. Verdächtige Herde müssen mit Röntgenuntersuchungen, CT, MRT oder Knochenbiopsie bestätigt werden.
Bei einem PSA unter 10 ng/ml ist die Rate an Knochenmetastasen bei einem Prostatakarzinom sehr niedrig (1,3 %), bei gleichbleibender Häufigkeit von falsch-positiven Befunden. Bei einem PSA unter 10 ng/ml, einer Gleason-Summe unter 8, klinisch lokalisiertem Tumorstadium und fehlenden Knochenschmerzen soll vor kurativer Therapie auf ein Knochenszintigramm verzichtet werden.
 |
Computertomographie
Bei einem Prostatakarzinom mit einem PSA unter 20 ng/ml und einer Gleason-Summe unter 7 sind sehr selten pathologische Befunde zu erwarten. Die Aussagekraft vergrößerter Lymphknoten ist unspezifisch. Das CT ist bei fortgeschrittenem Prostatakarzinomen indiziert, entweder in Kombination mit einer Knochenszintigraphie oder PET (siehe nächster Abschnitt).
Positronenemissionstomographie
Das PET (in Kombination mit einem CT oder MRT) erreicht eine sehr hohe diagnostische Aussagekraft und ist der Kombination Knochenszintigraphie und CT überlegen (Bukavina u.a., 2023). Als Tracer wird 68Ga-PSMA verwendet. Indikationen für das PSMA-PET-CT sind das Prostatakarzinom mit hohem Risiko, biochemisches Rezidiv nach kurativer Therapie oder Progress unter systemischer Therapie des metastasierten Prostatakarzinoms.
Multiparameter-MRT der Prostata
Das mpMRT der Prostata ist für die Bildgebung des lokal fortgeschrittenen Prostatakarzinoms indiziert, wenn die Ergebnisse der Bildgebung die Behandlungsentscheidung ändern würden.
Pelvine Lymphadenektomie
Ohne eine operative Entfernung und pathologische Analyse der Lymphknoten ist bei einem Prostatakarzinom eine genaue diagnostische Aussage bezüglich eventueller Lymphknotenmetastasen nicht möglich. Die Bildgebung kann nur die Lymphknotenvergrößerung erfassen und ist damit zu wenig sensibel und spezifisch. Eine Indikation für das operative (laparoskopische) Lymphknotenstaging als isolierter Eingriff besteht bei Patienten mit höherem Risiko der Lymphknotenmetastasierung, insbesondere vor perinealer Prostatektomie oder Brachytherapie bei Prostatakarzinom.
Die Dissektionsgrenzen der Lymphadenektomie sind lateral die A. iliaca externa, kaudal der Ramus superior des Os pubis, medial das Lig. umbilicale und die Harnblase, in der Tiefe der N. obturatorius und die Beckenwand, kranial der Ureter und die Gabelung der A. iliaca communis. Für eine höhere Sensitivität ist das Dissektionsfeld nach medial zu erweitern (Lymphknoten entlang der A. iliaca interna). Technik und Komplikationen siehe Kapitel Operationstechniken/pelvine Lymphadenektomie.
Bei Niedrigrisiko-Karzinomen (Gleason <7 und PSA <10) ist die Wahrscheinlichkeit der Lymphknotenmetastasierung sehr gering (<5 %). Bei Niedrigrisiko-Patienten ist die Notwendigkeit des operativen Lymphknotenstagings selbst bei der retropubischen Prostatektomie umstritten, bei anderen kurativen Verfahren wird darauf verzichtet. Manche Autoren vertreten die Meinung, die Häufigkeit für Lymphknotenmetastasen wird in den Partin-Tabellen unterschätzt. Ursache sei das zu kleine Dissektionsfeld der Lymphadenektomie in den klinischen Serien, welche die Grundlage der Tabellen bilden. Es wird bei jeder radikalen Prostatektomie eine ausgedehnte pelvine Lymphadenektomie gefordert.
Als Alternative zum Verzicht auf eine Lymphadenektomie wird in einzelnen Zentren bei einem Prostatakarzinom die Sentinel-Lymphadenektomie durchgeführt. Nach Injektion eines radioaktiven Tracers in die Prostata werden die Sentinel-Lymphknoten intraoperativ mit der Gamma-Sonde detektiert und entfernt. Dadurch wird das Dissektionsfeld limitiert, die Sensitivität ist höher als bei der Standard-Lymphadenektomie (Wawroschek u.a., 2003). Es fehlen kontrollierte Studien, weiterhin ist der personelle und materielle Aufwand erhöht.
Experimentelle diagnostische Methoden des Prostatakarzinoms
Neue Screening- oder Tumormarker: PCA3
PCA3 (prostate cancer antigen 3)
PCA3 ist eine nicht proteinkodierende RNA, welche durch das Prostatakarzinom hochgradig überexprimiert wird und im Urin nach einer Prostatamassage detektiert werden kann. Erste Studien weisen auf eine bessere Sensitivität und Spezifität des PCA3 für die Detektion des Prostatakarzinoms bei Männern mit erhöhtem PSA hin. Weiterhin könnte PCA3 eine Rolle in zukünftigen Therapiealgorithmen spielen, da das Tumorvolumen sehr gut vorhergesagt werden kann (Auprich u.a., 2011). Problematisch sind die Kosten, ein PCA3-Test kostete 2016 rund 330 Euro.
Analyse der Genexpression
Prolaris ist ein diagnostischer Test von Myriad Genetics, welcher die RNA-Expression von Zellzyklusgenen analysiert. Es werden 30 Gene der Proliferation versus 15 Housekeeping-Gene in Stanzzylindern der Prostatabiopsie untersucht. Der Test soll u.a. die Risikostratifizierung in der aktiven Überwachung verbessern (Cuzick u.a., 2012), kontrollierte Studien liegen hierzu aber nicht vor. Der Test ist teuer (um die 3000 Dollar).
Weitere Methoden:
Mikrometastasen im Knochenmark, RT-PCR zur Detektion von PCA im Blut oder Lymphknoten.
Neue bildgebende Verfahren:
Neue Methoden wie Positronenemisionstomographie (PET), MRT mit speziellen Kontrastmitteln und spezielle Ultraschalltechniken werden in klinischen Serien erprobt.
Mikro-Ultraschall:
Die gezielte Prostatabiopsie mit einer hochauflösenden TRUS-Sonde (ExactVu mit 29 MHz) konnte in mehreren Studien bessere Ergebnisse erreichen als die konventionelle systematische Biopsie (Dariane u.a., 2022).
Elastographie:
Mit Hilfe einer Ultraschallsonde und Druck auf die Prostata kann die Elastizität des Prostatagewebes farbig dargestellt werden. Weniger elastische Regionen sind karzinomverdächtig, die Elastographie ist besser in der Prostatakarzinomdetektion als die Grauwert-Bildgebung. Die Sensitivität und Spezifität der Elastographie von 60–70% bei Patienten mit Verdacht auf Prostatakarzinom sind jedoch nicht ausreichend, um auf eine systematische Prostatabiopsie zu verzichten (Brock u.a., 2012). Die Elastographie ermöglicht jedoch gezielte Biopsien im Rahmen der Prostatabiopsie.
Analyse der Ultraschall-Rohdaten:
Die datenbankgestützte Analyse der Ultraschallsonden-Rohdaten (HistoScanning) kann besser als die Grauwert-Bildgebung das Prostatakarzinom detektieren. Das Verfahren wird bereits kostenpflichtig angeboten (pro Anwendung 200–500 Euro je nach Abrechnungsfaktor). Unabhängige aktuelle Studien konnten leider keinen überzeugenden Daten für die Sensitivität und Spezifität von HistoScanning ermitteln (Schiffmann u.a., 2014) (Javed u.a., 2014).
Neue MRT-Techniken:
Zur Detektion von Lymphknotenmetastasen verbessern magnetischen Nanopartikeln (Harisinghani u.a., 2003) oder die diffusionsgewichtete Bildgebung (DWI) die Sensitivität.
| Prostatakarzinom | Suchen | Prostatakarzinom |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Afshar-Oromieh, A.; Haberkorn, U.; Schlemmer, H. P.;
Fenchel, M.; Eder, M.; Eisenhut, M.; Hadaschik, B. A.; Kopp-Schneider, A.
& Röthke, M.
Comparison of PET/CT and PET/MRI hybrid systems
using a 68Ga-labelled PSMA ligand for the diagnosis of recurrent prostate
cancer: initial experience.
Eur J Nucl Med Mol Imaging, 2014,
41, 887-897
Auprich, M.; Bjartell, A.; Chun, F. K.; de la Taille,
A.; Freedland, S. J.; Haese, A.; Schalken, J.; Stenzl, A.; Tombal, B. &
van der Poel, H.
Contemporary role of prostate cancer antigen 3 in the
management of prostate cancer.
Eur Urol, 2011, 60,
1045-1054.
Brock, M.; von Bodman, C.; Palisaar, R. J.; Löppenberg,
B.; Sommerer, F.; Deix, T.; Noldus, J. & Eggert, T.
The Impact of
Real-Time Elastography Guiding a Systematic Prostate Biopsy to Improve
Cancer Detection Rate: A Prospective Study of 353 Patients.
J Urol, 2012.
D'Amico, A. V.; Moul, J.; Carroll, P. R.; Sun, L.;
Lubeck, D. & Chen, M.
Cancer-specific mortality after surgery or
radiation for patients with clinically localized prostate cancer managed
during the prostate-specific antigen era.
J Clin Oncol, 2003,
21, 2163-2172.
D'Amico, A. V.; Hui-Chen, M.; Renshaw, A. A.; Sussman,
B.; Roehl, K. A. & Catalona, W. J.
Identifying men diagnosed with
clinically localized prostate cancer who are at high risk for death from
prostate cancer.
J Urol, 2006, 176, S11-S15.
Guidelines on Prostate Cancer of the European Association of Urology (EAU), https://uroweb.org/guidelines/prostate-cancer/.
Harisinghani u.a. 2003 HARISINGHANI, M. G. ;
BARENTSZ, J. ; HAHN, P. F. ; DESERNO, W. M. ;
TABATABAEI, S. ; KAA, C. H. van de ; ROSETTE, J.
de la ; WEISSLEDER, R.:
Noninvasive detection of clinically occult lymph-node metastases in
prostate cancer.
In: N Engl J Med
348 (2003), Nr. 25, S. 2491–9
Javed, S.; Chadwick, E.; Edwards, A. A.; Beveridge, S.;
Laing, R.; Bott, S.; Eden, C. & Langley, S.
Does prostate
HistoScanning™ play a role in detecting prostate cancer in routine
clinical practice? Results from three independent studies.
BJU Int, 2014,
114, 541-548
Kattan u.a. 1998 KATTAN, M. W. ; EASTHAM,
J. A. ; STAPLETON, A. M. ; WHEELER, T. M. ;
SCARDINO, P. T.:
A preoperative nomogram for disease recurrence following radical
prostatectomy for prostate cancer.
In: J Natl Cancer Inst
90 (1998), Nr. 10, S. 766–71
Kattan u.a. 2001 KATTAN, M. W. ; POTTERS, L. ;
BLASKO, J. C. ; BEYER, D. C. ; FEARN, P. ;
CAVANAGH, W. ; LEIBEL, S. ; SCARDINO, P. T.:
Pretreatment nomogram for predicting freedom from recurrence after
permanent prostate brachytherapy in prostate cancer.
In: Urology
58 (2001), Nr. 3, S. 393–9
Kattan u.a. 2003 KATTAN, M. W. ; ZELEFSKY,
M. J. ; KUPELIAN, P. A. ; CHO, D. ; SCARDINO,
P. T. ; FUKS, Z. ; LEIBEL, S. A.:
Pretreatment nomogram that predicts 5-year probability of metastasis
following three-dimensional conformal radiation therapy for localized
prostate cancer.
In: J Clin Oncol
21 (2003), Nr. 24, S. 4568–71
Perdonà, S.; Cavadas, V.; Lorenzo, G. D.; Damiano, R.;
Chiappetta, G.; Prete, P. D.; Franco, R.; Azzarito, G.; Scala, S.; Arra,
C.; Sio, M. D. & Autorino, R.
Prostate Cancer Detection in the
"Grey Area" of Prostate-Specific Antigen Below 10 ng/ml: Head-to-Head
Comparison of the Updated PCPT Calculator and Chun's Nomogram, Two Risk
Estimators Incorporating Prostate Cancer Antigen 3.
Eur Urol, 2010
Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms, Langversion 3.1, 2014 AWMF Registernummer: 034/022OL, https://www.awmf.org//leitlinien/detail/ll/043-022OL.html (Zugriff am: 07.02.2016)
Wein, A. J.; Kavoussi, L. R.; Partin, A. P. & Peters, C. A.
Campbell-Walsh Urology
. Elsevier, 2015. ISBN 978-1455775675.
Sanz u.a. 2004 SANZ, G. ; RIOJA, J. ;
ZUDAIRE, J. J. ; BERIAN, J. M. ; RICHTER, J. A.:
PET and prostate cancer.
In: World J Urol
22 (2004), Nr. 5, S. 351–2
Schiffmann, J.; Tennstedt, P.; Fischer, J.; Tian, Z.;
Beyer, B.; Boehm, K.; Sun, M.; Gandaglia, G.; Michl, U.; Graefen, M. &
Salomon, G.
Does HistoScanning™ predict positive results in prostate
biopsy? A retrospective analysis of 1,188 sextants of the prostate.
World
J Urol, 2014, 32, 925-930.
Smaletz u.a. 2002 SMALETZ, O. ; SCHER, H. I. ;
SMALL, E. J. ; VERBEL, D. A. ; MCMILLAN, A. ;
REGAN, K. ; KELLY, W. K. ; KATTAN, M. W.:
Nomogram for overall survival of patients with progressive metastatic
prostate cancer after castration.
In: J Clin Oncol
20 (2002), Nr. 19, S. 3972–82
Wawroschek u.a. 2003 WAWROSCHEK, Friedhelm ;
WAGNER, Theodor ; HAMM, Michael ; WECKERMANN,
Dorothea ; VOGT, Harry ; MäRKL, Bruno ; GORDIJN,
Ronald ; HARZMANN, Rolf:
The influence of serial sections, immunohistochemistry, and extension
of pelvic lymph node dissection on the lymph node status in clinically
localized prostate cancer.
In: Eur Urol
43 (2003), Feb, Nr. 2, S. 132–6; discussion 137
 English Version: Prostate carcinoma
English Version: Prostate carcinoma