Sie sind hier: Startseite > Prostata > Prostatakarzinom > Kastrationsresistentes Prostatakarzinom
Olaparib, Chemotherapie und Hormontherapie des kastrationsresistenten Prostatakarzinoms (CRPC)
- Prostatakarzinom: Definition, Epidemiologie und Ursachen
- Prostatakarzinom: Pathologie
- Prostatakarzinom: Klinik, Vorsorgeuntersuchung, PSA
- Prostatakarzinom: Diagnose, Bildgebung, Staging
- Prostatakarzinom: Therapieübersicht, aktive Überwachung
- Prostatakarzinom: Operation
- Prostatakarzinom: Therapie (Strahlentherapie)
- Prostatakarzinom: Therapie (Brachytherapie, Kryotherapie, HIFU)
- Prostatakarzinom: kastrationssensibles Prostatakarzinom
- Prostatakarzinom: kastrationsresistentes Prostatakarzinom, Prävention
Definition und Diagnose des kastrationsresistenten Prostatakarzinoms (CRPC)
Definition:
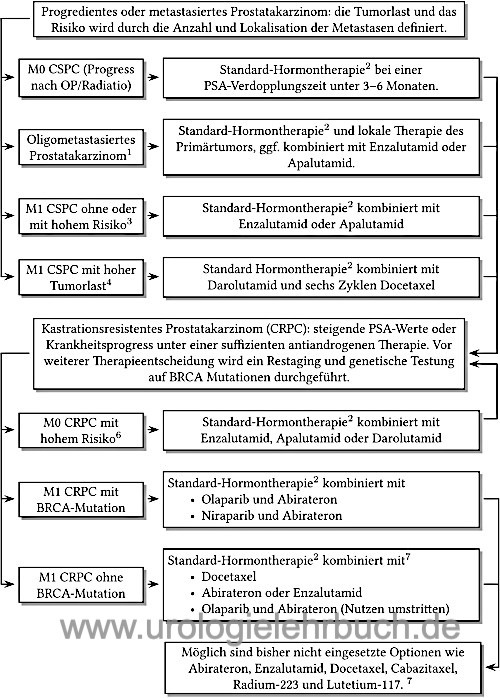
Das kastrationsresistente Prostatakarzinom (CRPC) ist durch steigende PSA-Werte oder Krankheitsprogress unter einer suffizienten antiandrogenen Therapie definiert. Je nach Nachweis von Metastasen in der Bildgebung wird vom Stadium M0 CRPC oder M1 CRPC gesprochen. Das M0 CRPC mit hohem Risiko hat eine PSA-Verdoppelungszeit von unter 10 Monaten.
Da das kastrationsresistente Prostatakarzinom weiterhin eine Hormonabhängigkeit zeigt, sollte die alte Bezeichung hormonrefraktäres Prostatakarzinom (HRPC) nicht mehr verwendet werden (Miller, 2011). Die Fortsetzung der Androgendeprivation ist trotz Kastrationsresistenz sinnvoll und notwendig, sie verbessert die Prognose und ist die Basistherapie der im folgenden aufgeführten erweiterten Hormontherapie, siehe Abb. Abb. Hormontherapie.
Mechanismus der Kastrationsresistenz:
- Veränderungen des Androgenrezeptors (Genamplifikation, Überexpression)
- Überexpression des Antiapoptose-Gens Bcl-2
- Aktivierung androgenunabhängiger Signaltransduktionswege für die Proliferation
- Androgenrezeptorkofaktoren erhöhen die Rezeptoraktivität
- intrazelluläre Synthese von Testosteron aus Cholesterin
Diagnostik bei CRPC:
Zur Diagnosesicherung soll die Effektivität der medikamentösen Kastration durch eine Testosteronbestimmung kontrolliert werden.
Bildgebung:
Der Standard zum Nachweis von Metastasen sind ein CT (Abdomen und Thorax) und eine Knochenszintigraphie. Die moderne Bildgebung (PSMA-PET) führt zu einem früheren Metastasennachweis, unten genannte Empfehlungen (und Studienergebnisse) bei CRPC M0 oder M1 beruhen jedoch auf den Ergebnissen der Standardbildgebung. Der Zusatznutzen ist des PSMA-PET ist unklar. Bei Progress der Erkrankung sollte die Bildgebung wiederholt werden.
Laborkontrollen:
Alle drei Monate PSA-Konzentration. Je nach Symptomatik oder V.a. Progress zusätzlich Blutbild, Elektrolyte, Kreatinin, Leberwerte und AP.
Genetische Testung:
BRCA1/2 Mutationen sind bei 11% der Patienten mit CRPC im Tumorgewebe nachweisbar, davon sind etwa die Hälfte Keimbahnmutationen und die andere Hälfte somatische Mutationen (nur im Tumorgewebe). Patienten mit BRCA-Mutationen profitieren besonders von einer Therapie mit Olaparib (siehe unten).
Therapie des kastrationsresistenten Prostatakarzinoms (CRPC)
PARP-Inhibitor Olaparib:
Die Poly-ADP-Ribose-Polymerase (PARP) beteiligt sich an der DNA-Reparatur der Zelle. Der PARP-Inhibitor Olaparib zeigte in der Zulassungsstudie ein deutliches Ansprechen bei Patienten mit BRCA-Mutationen und CRPC, welche unter Enzalutamid oder Abirateron progredient waren: verlängertes progressionsfreies Überleben (7 vs. 4 Monate) und verlängertes Überleben (19 vs. 15 Monate). Die Hauptnebenwirkungen sind Anämie und Übelkeit (Bono u.a., 2020). Olaparib (Lynparza) ist seit 2020 in Europa zugelassen, Voraussetzungen sind Progress des CRPC unter neuerer Hormontherapie und der Nachweis von BRCA1/2-Mutationen.
Kombination von Olaparib mit Abirateron:
Die Kombination von Olaparib mit Abirateron zeigte in der PROpel-Studie bei Patienten mit M1 CRPC und fehlender Eignung für eine Chemotherapie eine Verlängerung des progressionsfreien Überlebens (25 vs. 17 Monate) unabhängig vom BRCA Mutationsstatus (Saad et al, 2022). Das Gesamtüberleben war ebenfalls verbessert (42 vs. 35 Monate), in der Subgruppenanalyse zeigte sich aber bei Patienten ohne BRCA-Mutationen nur ein sehr geringer Vorteil. Die Kombination von Abirateron, Prednisolon und Olaparib ist seit 2023 als Erstlinientherapie des M1 CRPC in Europa ohne genetische Testung zugelassen. In den USA wurde die Zulassung auf Patienten mit BRCA-Mutationen beschränkt, es existieren Bedenken hinsichtlich des Nutzen-Risiko-Verhältnisses bei Patienten ohne BRCA-Mutationen.
PARP-Inhibitor Niraparib mit Abirateron
Die MAGNITUDE-Studie (Chi u.a., 2023) zeigte bei Patieten mit CRPC und BRCA-Mutationen, bei denen eine Chemotherapie nicht indiziert war, eine Verlängerung des progressionsfreien Überlebens (20 vs. 11 Monate). Dies zeigte sich auch bei Patienten mit HRR (homologous recombination repair) Genmutationen (17 vs. 14 Monate). Die Analyse zum Gesamtüberleben zeigt (bisher) keine Unterschiede. Die fixe Kombination Akeega (Niraparib/Abirateron 100 mg/500 mg, zwei Tabletten täglich) ist seit 2023 in Europa für die Erstlinientherapie bei Patienten mit CRPC und BRCA-Mutationen zugelassen.
PARP-Inhibitor Talazoparib mit Enzalutamid:
Die TALAPRO2-Studie (Agarwal u.a., 2023) zeigte bei Patieten mit CRPC eine Verlängerung des progressionsfreien Überlebens (HR 0,63). Eine Analyse zum Gesamtüberleben liegt noch nicht vor. In der Subgruppenanalyse zeigte sich bei Patienten ohne BRCA-Mutationen ein deutlich geringerer Vorteil (HR 0,70), bei Patienten mit BRCA-Mutationen war der Unterschied deutlich (HR 0,2). Talazoparib mit Enzalutamid ist seit 2024 in Europa für die Erstlinientherapie bei Patienten mit CRPC zugelassen, wenn eine Chemotherapie klinisch nicht indiziert ist. Für eine Behandlung mit Talazoparib ist der Nachweis einer BRCA-Mutation nicht obligat. In den USA ist Talazoparib nur bei BRCA-Mutationen zugelassen. Die empfohlene Dosis für die Kombination beträgt 0,5 mg Talazoparib und 160 mg Enzalutamid einmal täglich.
Glukokortikoide bei kastrationsresistentem Prostatakarzinom:
Glukokortikoide können eine schwache Remission bewirken und sind eine Option in der Palliativmedizin. Bei allen Therapieschemata mit Abirateron muss ebenfalls Prednisolon (10 mg/d) verordnet werden.
Abirateron bei M1 CRPC:
Abirateron ist ein CYP-17-Inhibitor und somit ein Hemmer der Testosteron-Biosynthese. Abirateron ist (auch ohne Olaparib) zugelassen für die Therapie des M1 CRPC vor und nach Docetaxel-Chemotherapie. Dosierung: 1000 mg 1-0-0 p.o. in Kombination mit Prednisolon 10 mg/d und Standard-Androgendeprivation. Abirateron verlängert bei Patienten mit CRPC (nach Docetaxel-Chemotherapie) das Überleben (14,8 vs. 10,9 Monate gegen Placebo) (Bono u.a., 2011). Abirateron verbessert auch die Prognose in der Anwendung vor Docetaxel-Chemotherapie: Verlängerung des progressionsfreien Überlebens (16,5 vs. 8,3 Monate) und des Gesamtüberlebens (Ryan u.a., 2013). Nebenwirkungen sind Ödembildung, Hypokaliämie und Hypertonie durch Erhöhung der Mineralokortikoide . Wichtige Nebenwirkungen sind Hepatotoxizität, Ödembildung, Hypokaliämie und Hypertonie durch Erhöhung der Mineralokortikoide, weitere Details siehe Pharmakologie und Nebenwirkungen von Abirateron. Die Behandlung wird bei Progress oder Unverträglichkeit beendet.
Enzalutamid bei M0 und M1 CRPC:
Enzalutamid ist ein Androgenrezeptorantagonist, welcher im Vergleich zu Bicalutamid stärker am Androgenzeptor bindet und zusätzlich die Translokation des aktivierten Androgenrezeptor in den Zellkern verhindert. Enzalutamid ist zugelassen für die Therapie des M0 CRPC mit hohem Risiko und des M1 CRPC vor und nach Docetaxel-Chemotherapie. Die Dosierung beträgt 160 mg Enzalutamid (vier 40 mg Kapseln) p.o. einmal täglich in Kombination mit Standard-Androgendeprivation. Die zusätzliche Gabe von Prednisolon ist möglich, aber nicht notwendig. In Phase III-Studien zeigte sich mit Enzalutamid ein signifikant verlängertes Gesamtüberleben nach Docetaxel-Chemotherapie im Vergleich zu Placebo (18,4 vs. 13,6 Monate), die Nebenwirkungsrate entsprach weitgehend der Placebogruppe (Scher u.a., 2012). In der PREVAIL-Studie wurde auch eine hohe Wirksamkeit von Enzalutamid vor Chemotherapie bei kastrationsresistentem Prostatakarzinom gezeigt: längeres progressionsfreies Überleben, damit spätere Notwendigkeit der Chemotherapie, welche sogar in der Enzalutamid-Gruppe erfolgreicher (Beer u.a., 2014). Die PROSPER-Studie zeigte die Wirksamkeit bei M0 CRPC mit hohem Risiko (PSA-Verdopplungszeit unter 10 Monate): Verlängerung des metastasenfreien Überlebens 37 vs. 15 Monate (Hussain u.a., 2018). Wichtige Nebenwirkungen sind Hitzewallungen, Durchfall, Kopfschmerzen und selten Epilepsie, weitere Details siehe Pharmakologie und Nebenwirkungen von Enzalutamid. Die Behandlung wird bei Progress oder Unverträglichkeit beendet.
Apalutamid bei M0 CRPC:
Apalutamid ist ein Androgenrezeptorantagonist, welcher die Translokation des aktivierten Androgenrezeptor in den Zellkern und damit die Transkription der Zielgene verhindert. Apalutamid ist zugelassen für die Therapie des M0 CRPC mit hohem Risiko (PSA-Verdopplungszeit unter 10 Monate). Die Dosierung beträgt 240 mg (vier 60 mg Kapseln) p.o. einmal täglich in Kombination mit Standard-Androgendeprivation. Apalutamid konnte bei M0 CRPC mit hohem Risiko (PSA-Verdopplungszeit unter 10 Monate) eine Verlängerung des medianen metastasenfreien Überlebens (41 versus 16 Monate) erreichen (Smith u.a, NEJM 2018, SPARTAN). Wichtige Nebenwirkungen sind Hautausschläge, weitere Details siehe Pharmakologie und Nebenwirkungen von Apalutamid. Die Behandlung wird bei Progress oder Unverträglichkeit beendet.
Darolutamid bei M0 CRPC:
Darolutamid ist ein Androgenrezeptorantagonist, welcher die Translokation des aktivierten Androgenrezeptor in den Zellkern und damit die Transkription der Zielgene verhindert. Darolutamid ist zugelassen für die Therapie des M0 CRPC mit hohem Risiko (PSA-Verdopplungszeit unter 10 Monate). Die Dosierung beträgt Dosierung 600 mg Darolutamid (zwei 300 mg Kapseln) p.o. morgens und abends mit den Mahlzeiten, Tagesdosis 1200 mg. Die zusätzliche Gabe von Prednisolon wird nicht empfohlen. In der Zulassungsstudie (ARAMIS) verbesserte die Behandlung mit Darolutamid kombiniert mit der klassischen antiandrogenen Therapie das metastasenfreie Überleben (40 Monate vs. 18 Monate mit Placebo und Hormontherapie), das Gesamtüberleben war im Trend ebenfalls besser (Fizazi u.a., 2019). Nebenwirkungen und weitere Details siehe Pharmakologie und Nebenwirkungen von Darolutamid.
Docetaxel: Erstlinien-Chemotherapie des kastrationsresistenten Prostatakarzinoms
Hinsichtlich der Überlebenszeit ist durch eine Chemotherapie nur eine moderate Verbesserung möglich. Die Chemotherapie führt jedoch zusätzlich zu einer Besserung der Schmerzen bei fortgeschrittener Erkrankung. Die Indikation für den Beginn einer Chemotherapie bei kastrationsresistentem Prostatakarzinom sind tumorbedingte Schmerzen und ein schneller PSA-Progress (PSA-Verdoppelungszeit unter 3 Monaten).
Die dreiwöchentliche Gabe von Docetaxel 75 mg/m2 in Kombination mit Prednisolon ist die wirksamste Kombination, eine Lebensverlängerung von 3 Monaten (19,2 vs. 16,3) ist im Vergleich zur Mitoxantron-Chemotherapie erreichbar. Es profitieren vor allem Patienten ohne viszerale Metastasen mit einem guten PSA-Ansprechen und gutem Karnofsky-Index (Berthold u.a., 2008). Pharmakologie und Nebenwirkungen von Docetaxel siehe Kapitel Chemotherapie/Docetaxel .
Cabazitaxel: Zweitlinien-Chemotherapie des kastrationsresistenten Prostatakarzinoms:
Cabazitaxel, ein Taxan, ist ein wirksames Chemotherapeutikum bei Progress des CRPC unter oder nach Chemotherapie mit Docetaxel. Das Gesamtüberleben betrug 15,1 vs. 12,7 Monate im Vergleich mit einer Mitoxantron-Chemotherapie (Bono u.a., 2010). Dosierung von Cabazitaxel: 25 mg/m2 i.v. alle drei Wochen, zusätzlich Prednisolon 10 mg/d.
Prävention von ossären Komplikationen des kastrationsresistenten Prostatakarzinoms
30–50% der Patienten mit fortgeschrittenem Prostatakarzinom leiden unter pathologischen Frakturen aufgrund von Skelettmetastasen. Die regelmäßige Gabe eines Bisphosphonates (Zoledronsäure) oder eines RANK-Ligand-Inhibitors (Denosumab) hemmt die Osteoklasten und senkt die Morbidität infolge der Komplikationen von Knochenmetastasen. Beide Medikamente werden ab dem kastrationsresistenten Stadium und bei symptomatischen Knochenmetastasen und bei erhöhtem Frakturrisiko empfohlen.
Zoledronsäure:
Das Bisphosphonat Zoledronsäure zeigte in Phase III-Studien eine Reduktion der Skelettkomplikationen (33 vs. 44%), kontrolliert gegen Placebo (Saad u.a., 2004). Renale Nebenwirkungen und die Kieferosteonekrose (2–5%) sind schwere Komplikationen. Dosierung: 4 mg Zoledronsäure i.v. alle 4 Wochen.
Denosumab:
Denosumab ist ein humaner monoklonaler Antikörper, welcher über Interaktion mit RANKL und RANK die Osteoklasten hemmt. Denosumab wurde in einer Phase III-Studie vorteilhaft gegen Zoledronsäure getestet: 20,7 Monate vs. 17,1 Monate bis zum Auftreten erster Skelettkomplikationen. Denosumab wird subkutan verabreicht, die Dosierung beträgt 120 mg alle 4 Wochen. Die Häufigkeit der Kieferosteonekrose ist vergleichbar wie bei Zoledronsäure (Fizazi u.a., 2011). Zur Prävention der Osteoporose beträgt die Dosierung von Denosumab 60 mg s.c. alle 6 Monate.
Strahlentherapie der Knochenmetastasen des Prostatakarzinoms
Bestrahlung von schmerzhaften Knochenmetastasen des Prostatakarzinoms:
Bei einzelnen oder wenigen gut lokalisierbaren schmerzhaften Knochenmetastasen ist die palliative perkutane Strahlentherapie die Methode der Wahl. Normalerweise werden 30 Gy in 10 Fraktionen appliziert, möglich ist auch die Einmalgabe von 8 Gy.
Intravenöse Radionuklide
Als modernes Radiotherapeutikum ist 223Ra (Radium-223) seit 2014 zugelassen. Radium-223 wird hauptsächlich in Knochenumbauzonen und damit in Knochenmetastasen eingebaut und hat aufgrund der geringen Reichweite als Alphastrahler nur geringe Nebenwirkungen auf das Knochenmark und andere Gewebe. Die Halbwertszeit beträgt 11 Tage. In der Zulassungsstudie wurden Patienten mit ossär metastasiertem und kastrationsresistentem Prostatakarzinom ohne viszerale Metastasen mit sechs monatlichen 223Ra-Injektionen versus Placebo behandelt (Parker u.a., 2013). Signifikante Unterschiede zeigten sich im Überleben (15 vs. 11 Monate) und in der Zeit bis zur ersten Komplikation durch Knochenmetastasen (16 vs. 10 Monate). Die Nebenwirkungsrate war bis auf geringgradige Übelkeit und Durchfall in der Verumgruppe geringer: Knochenschmerzen (10 vs. 16%), Anämie (8 vs. 9%), Rückenmarkskompression (4 vs. 5%). Die Zulassung ist auf Pat. begrenzt, welche bereits zwei andere systemische Therapieoptionen erhielten oder keine anderen Therapieoptionen bestehen. Aufgrund des erhöhten Frakturrisikos darf 223Ra nicht in der Kombination mit Abirateron gegeben werden.
Ein neuer Therapieansatz eröffnet sich mit 117Lutetium-PSMA-Liganden, welche spezifisch an PSMA-exprimierenden Prostatakarzinomzellen binden. Die Metastasen sollten im diagnostischen PSMA-PET ausreichend Tracer aufnehmen. In der Zulassungsstudie zeigte Lutetium-117 bei stark vorbehandelten Patienten eine Verlängerung des progressionsfreien Überlebens (8,7 vs. 3,4 Monate) und des Gesamtüberlebens (15 vs. 11 Monate) (Sartor u.a., 2021). Eine komplette Remission konnte bei 9% der Patienten erreicht werden. Die häufigsten Nebenwirkungen waren Fatigue, Übelkeit, Mundtrockenheit, Verschlechterung der Nierenfunktion und Anämie. 117Lu-PSMA (Pluvicto) wurde 2022 in Europa und USA für Patienten mit PSMA-positiven progredienten CRPC nach Chemotherapie und Androgenrezeptorblockern zugelassen.
Therapie von Harnstau:
Durch lokalen Progress oder Lymphknotenmetastasen besteht die Möglichkeit einer obstruktiven Uropathie des oberen Harntrakts. Die Harnableitung mit Ureterstents hat eine hohe Versagerquote bei lokal fortgeschrittenem Prostatakarzinom mit Infiltration des Trigonums (Obstruktion, Infektion, Blutung und Schmerzen), die perkutane Nephrostomie ist dann notwendig (DGU, 2009).
Zukunftaussichten für die Therapie des kastrationsresistenten Prostatakarzinoms
Zahlreiche neue Substanzen zur Therapie des kastrationsresistenten Prostatakarzinoms befinden sich in der klinischen Prüfung.
PARP-Inhibitoren:
Rucaparib.
Cabozantinib:
Cabozantinib ist ein Tyrosinkinasehemmer mit Aktivität gegen MET und VEGFR und gutem Ansprechen in Phase II-Studie. In Phase III-Studien (COMET-1) wurde keine signifikante Lebensverlängerung nachgewiesen.
Immun-Checkpoint Inhibition:
In mehreren Phase I/II-Studien konnten Ipilimumab oder Pembrolizumab eine Antitumoraktivität nachweisen, in klinischen Studien konnte bisher kein Überlebensvorteil demonstriert werden.
CDK4/6 Inhibitoren:
Hemmer von Cyclin-abhängigen Kinasen (Ribociclib, Abemaciclib) werden in Kombination mit Chemotherapie oder neuerer Hormontherapie in Studien getestet.
PI3K/AKT-Signalweg:
Wichtiger Mechanismus der Kastrationsresistenz, mehrere Substanzen (Ipatasertib, Capivasertib) mit Einfluss auf den PI3K/AKT-Signalweg sind in der klinischen Prüfung.
Androgenrezeptor-Signalweg:
Weitere Androgensynthesehemmer und Androgenrezeptor-Degrader werden entwickelt.
Spezifische Immunsystemaktivierung:
Spezifische Immunsystemaktivierung gegen Prostatakarzinomproteine, mehrere Mechanismen werden erprobt: BiTE (bispezifischer T-Zell Engager) oder CAR (chimäre Antigenrezeptor)-T-Zellen.
Nachsorge des Prostatakarzinoms
Nachsorge nach kurativer Therapie
Die Nachsorgeuntersuchungen bestehen in der Beurteilung der Therapienebenwirkungen (Miktion, Sexualität, ...) und Bestimmung der PSA-Konzentration. Die rektale Untersuchung ist bei unauffälliger PSA-Konzentration nicht notwendig. Eine Bildgebung ist nur bei Verdacht eines Lokalrezidivs oder Krankheitsprogress sinnvoll und wenn die Bildgebung Einfluss auf die weitere Therapie hat. Zu den Einzelheiten der Diagnostik und Therapie bei einem Rezidiv nach RPE oder EBRT siehe entsprechende Abschnitte oben.
Die Empfehlungen der Zeitpunkte der Nachsorgen sind nicht systematisch untersucht worden. Die EAU-Leitlinien empfehlen folgende Zeitpunkte: dreimal im ersten Jahr (3, 6 und 12 Monate nach Therapie), alle 6 Monate im zweiten und dritten Jahr nach Therapie, danach jährlich.
Nachsorge unter Hormontherapie
Drei und sechs Monate nach Beginn einer Hormontherapie sollte die Verträglichkeit und der klinische Erfolg (Beschwerden, PSA-Werte) ermittelt werden. Die Testosteronbestimmung ist fakultativ, jedoch obligat bei schlechtem Ansprechen der Therapie mit GnRH-Analoga.
Die weiteren Nachsorgeuntersuchungen werden individuell in Abhängigkeit des Progressionsrisikos gestaltet. Bei Patienten im Stadium M0 mit gutem Ansprechen der Hormontherapie genügen PSA-Kontrollen und klinische Untersuchungen alle 6 Monate. Patienten mit klinischen Metastasen benötigen häufiger Kontrollen, zusätzlich Bestimmung von Blutbild, Kreatinin, Leberwerte und AP. Die Bildgebung sollte nach Beschwerdebild und klinischer Konsequenz individuell durchgeführt werden.
Prävention des Prostatakarzinoms
5α-Reduktasehemmer und Prostatakarzinomrisiko
Aus den Langzeit-Studien der 5α-Reduktasehemmer zur BPH-Therapie ist eine niedrigere Inzidenz des Prostatakarzinoms in den Verum-Gruppen aufgefallen. Für Finasterid ist in einer randomisierten Studie der Nachweis über die geringere Inzidenz erbracht worden, jedoch war die Rate an undifferenzierten Tumoren in der Verum-Gruppe höher. Für Dutasterid konnte in der REDUCE-Studie der Nachweis einer verminderten Inzidenz erbracht werden. Nach 4 Jahren Therapie mit Dutasterid 0,5 mg/d betrug die Neuerkrankungsrate bei Patienten mit erhöhtem Risiko 20% (Dutasterid) vs. 25% (Plazebo) (Andriole u.a, 2010). Der Einfluss von Dutasterid auf die Mortalität des Prostatakarzinoms wurde aufgrund der kurzen Nachbeobachtungszeit nicht untersucht. Die FDA rät von der Chemoprophylaxe mit 5α-Reduktasehemmer ab.
Selen und Prostatakarzinomrisiko
In prospektiven, randomisierten und Case-control-Studien konnte teilweise ein präventiver Effekt von Selen auf die Entstehung des Prostatakarzinoms nachgewiesen werden. Die aussagekräftige SELECT-Studie (s.u.) konnte keinen präventiven Effekt nachweisen.
Antioxidantien und Prostatakarzinomrisiko:
Sowohl Vitamin C als auch Vitamin E haben antioxidative Eigenschaften, welche mit einer Reduktion von Krebserkrankungen in Verbindung gebracht werden. Die Physicians Health Study II (randomisiert, n=14 600) konnte keinen protektiven Effekt von Vitamin C oder Vitamin E nachweisen (Gaziano u.a., 2009). Dieses Ergebnis steht im Widerspruch zu den Resultaten der SU.VI.MAX-Studie.
Inhibition der Cyclooxygenase (COX) und Prostatakarzinomrisiko
Mehrere Studien konnten ein niedrigeres PCA-Risiko bei Patienten mit regelmäßiger Einnahme von Acetylsalicylsäure nachweisen. Bei der unspezifischen Inhibition der Cyclooxygenase ist das Nebenwirkungsprofil problematisch. Präventionsstudien mit COX-2-Inhibitoren stehen noch aus.
Studien mit mehreren Substraten zur Prävention des Prostatakarzinoms
Die Studienlage ist widersprüchlich, durch die aussagekräftige SELECT-Studie gilt die Substitution von Selen oder Vitamin E als nicht hilfreich gegen das Prostatakarzinom.
SELECT-Studie:
Substitution mit Selen, Vitamin E, Selen kombiniert mit Vitamin E oder Placebo (randomisiert, n=36 000 Männer): keine Unterschiede zwischen Verumgruppen und Placebo (Lippman u.a., 2009).
SU.VI.MAX-Studie:
Die tägliche Substitution mit Vitamin C, Vitamin E, beta-Carotin, Selen und Zink reduziert die Neuerkrankungsrate an PCA (randomisiert, n=5141, Therapiedauer 8 Jahre): bei einem PSA-Wert unter 3 ng/ml wird das Prostatakarzinomrisiko halbiert (HR 0,52). Der PSA-Wert ändert sich unter der Substitution nicht und ist somit als Marker für Präventionsstudien nicht verwendbar. Bei pathologischen PSA-Werten ist die Senkung des PCA-Risikos gering (HR 0,88) (Meyer u.a., 2005).
| Kastrationssensibles Prostatakarzinom | Suchen | Prostatasarkom |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
EAU Guidelines EAU - EANM - ESTRO - ESUR - SIOG Guidelines on Prostate Cancer, https://uroweb.org/guidelines/prostate-cancer/.
N. Agarwal et al., “Talazoparib plus enzalutamide in men with first-line metastatic castration-resistant prostate cancer (TALAPRO-2): a randomised, placebo-controlled, phase 3 trial.,” Lancet, vol. 402, no. 10398, pp. 291–303, 2023, doi: 10.1016/S0140-6736(23)01055-3.
Andriole, G. L.; Bostwick, D. G.; Brawley, O. W.;
Gomella, L. G.; Marberger, M.; Montorsi, F.; Pettaway, C. A.; Tammela, T.
L.; Teloken, C.; Tindall, D. J.; Somerville, M. C.; Wilson, T. H.; Fowler,
I. L.; Rittmaster, R. S. & Group, R. E. D. U. C. E. S.
Effect of
dutasteride on the risk of prostate cancer.
N Engl J Med, 2010,
362, 1192-1202
Beer, T. M.; Armstrong, A. J.; Rathkopf, D. E.; Loriot, Y.; Sternberg, C. N.; Higano, C. S.; Iversen, P.; Bhattacharya, S.; Carles, J.; Chowdhury, S.; Davis, I. D.; de Bono, J. S.; Evans, C. P.; Fizazi, K.; Joshua, A. M.; Kim, C.-S.; Kimura, G.; Mainwaring, P.; Mansbach, H.; Miller, K.; Noonberg, S. B.; Perabo, F.; Phung, D.; Saad, F.; Scher, H. I.; Taplin, M.-E.; Venner, P. M.; Tombal, B. und Investigators, P. R. E. V. A. I. L. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med, 2014, 371, 424-433.
D. R. Berthold, G. R. Pond, F. Soban, R. de Wit, M. Eisenberger, and I. F.
Tannock.
Docetaxel plus prednisone or mitoxantrone plus prednisone for
advanced prostate cancer: updated survival in the tax 327 study.
J Clin Oncol, 26 (2): 242–245, Jan 2008.
URL https://dx.doi.org/10.1200/JCO.2007.12.4008.
K. N. Chi, et al., “Niraparib and Abiraterone Acetate for Metastatic Castration-Resistant Prostate Cancer.,” J Clin Oncol., vol. 41, no. 18, pp. 3339–3351, 2023.
De Bono, J. S.; Oudard, S.; Ozguroglu, M.; Hansen, S.;
Machiels, J.; Kocak, I.; Gravis, G.; Bodrogi, I.; Mackenzie, M. J.; Shen,
L.; Roessner, M.; Gupta, S.; Sartor, A. O. & Investigators, T. R. O. P. I.
C.
Prednisone plus cabazitaxel or mitoxantrone for metastatic
castration-resistant prostate cancer progressing after docetaxel
treatment: a randomised open-label trial.
Lancet, 2010,
376, 1147-1154
De Bono, J. S.; Logothetis, C. J.; Molina, A.; Fizazi,
K.; North, S.; Chu, L.; Chi, K. N.; Jones, R. J.; Goodman, O. B.; Saad,
F.; Staffurth, J. N.; Mainwaring, P.; Harland, S.; Flaig, T. W.; Hutson,
T. E.; Cheng, T.; Patterson, H.; Hainsworth, J. D.; Ryan, C. J.;
Sternberg, C. N.; Ellard, S. L.; Fléchon, A.; Saleh, M.; Scholz, M.;
Efstathiou, E.; Zivi, A.; Bianchini, D.; Loriot, Y.; Chieffo, N.; Kheoh,
T.; Haqq, C. M.; Scher, H. I. & Investigators, C. O. U. A.
Abiraterone
and increased survival in metastatic prostate cancer.
N Engl J Med, 2011,
364, 1995-2005
Finlay, I. G.; Mason, M. D. & Shelley, M.
Radioisotopes
for the palliation of metastatic bone cancer: a systematic review.
Lancet
Oncol, 2005, 6, 392-400.
Fizazi, K.; Carducci, M.; Smith, M.; Damião, R.; Brown,
J.; Karsh, L.; Milecki, P.; Shore, N.; Rader, M.; Wang, H.; Jiang, Q.;
Tadros, S.; Dansey, R. & Goessl, C.
Denosumab versus zoledronic
acid for treatment of bone metastases in men with castration-resistant
prostate cancer: a randomised, double-blind study.
Lancet, 2011,
377, 813-822
Gaziano, J. M.; Glynn, R. J.; Christen, W. G.; Kurth, T.; Belanger, C.; MacFadyen, J.; Bubes, V.; Manson, J. E.; Sesso, H. D. &
Buring, J. E.
Vitamins E and C in the prevention of prostate and total
cancer in men: the Physicians' Health Study II randomized controlled trial.
JAMA,
2009, 301, 52–62
Goldfarb u.a. 2006 GOLDFARB, C. R. ;
SRIVASTAVA, Neil C. ; GROTAS, Aaron B. ; ONGSENG,
Fukiat ; NAGLER, Harris M.:
Radionuclide imaging in urology.
In: Urol Clin North Am
33 (2006), Aug, Nr. 3, S. 319–328
Lippman, S. M.; Klein, E. A.; Goodman, P. J.; Lucia, M.
S.; Thompson, I. M.; Ford, L. G.; Parnes, H. L.; Minasian, L. M.; Gaziano,
J. M.; Hartline, J. A.; Parsons, J. K.; Bearden, J. D.; Crawford, E. D.;
Goodman, G. E.; Claudio, J.; Winquist, E.; Cook, E. D.; Karp, D. D.;
Walther, P.; Lieber, M. M.; Kristal, A. R.; Darke, A. K.; Arnold, K. B.;
Ganz, P. A.; Santella, R. M.; Albanes, D.; Taylor, P. R.; Probstfield, J.
L.; Jagpal, T. J.; Crowley, J. J.; Meyskens, F. L.; Baker, L. H. &
Coltman, C. A.
Effect of selenium and vitamin E on risk of prostate
cancer and other cancers: the Selenium and Vitamin E Cancer Prevention
Trial (SELECT).
JAMA, 2009, 301, 39–51
Kantoff, P. W.; Higano, C. S.; Shore, N. D.; Berger, E.
R.; Small, E. J.; Penson, D. F.; Redfern, C. H.; Ferrari, A. C.; Dreicer,
R.; Sims, R. B.; Xu, Y.; Frohlich, M. W.; Schellhammer, P. F. &
Investigators, I. M. P. A. C. T. S.
Sipuleucel-T immunotherapy for
castration-resistant prostate cancer.
N Engl J Med, 2010,
363, 411-422
Meyer u.a. 2005 MEYER, F. ; GALAN, P. ;
DOUVILLE, P. ; BAIRATI, I. ; KEGLE, P. ;
BERTRAIS, S. ; ESTAQUIO, C. ; HERCBERG, S.:
Antioxidant vitamin and mineral supplementation and prostate cancer
prevention in the SU.VI.MAX trial.
In: Int J Cancer
116 (2005), Nr. 2, S. 182–6
Miller, K.
[Castration resistant prostate cancer 2011].
Aktuelle Urol, 2011, 42, 95-102
Ryan, C. J.; Smith, M. R.; de Bono, J. S.; Molina, A.;
Logothetis, C. J.; de Souza, P.; Fizazi, K.; Mainwaring, P.; Piulats, J.
M.; Ng, S.; Carles, J.; Mulders, P. F. A.; Basch, E.; Small, E. J.; Saad,
F.; Schrijvers, D.; Poppel, H. V.; Mukherjee, S. D.; Suttmann, H.;
Gerritsen, W. R.; Flaig, T. W.; George, D. J.; Yu, E. Y.; Efstathiou, E.;
Pantuck, A.; Winquist, E.; Higano, C. S.; Taplin, M.; Park, Y.; Kheoh, T.;
Griffin, T.; Scher, H. I.; Rathkopf, D. E. & Investigators, C. O. U. A.
Abiraterone
in metastatic prostate cancer without previous chemotherapy.
N Engl
J Med, 2013, 368, 138-148.
Parker, C.; Nilsson, S.; Heinrich, D.; Helle, S. I.;
O'Sullivan, J. M.; Fosså, S. D.; Chodacki, A.; Wiechno, P.; Logue, J.;
Seke, M.; Widmark, A.; Johannessen, D. C.; Hoskin, P.; Bottomley, D.;
James, N. D.; Solberg, A.; Syndikus, I.; Kliment, J.; Wedel, S.; Boehmer,
S.; Dall'Oglio, M.; Franzén, L.; Coleman, R.; Vogelzang, N. J.;
O'Bryan-Tear, C. G.; Staudacher, K.; Garcia-Vargas, J.; Shan, M.; Bruland,
Ø. S.; Sartor, O. & Investigators, A. L. S. Y. M. P. C. A.
Alpha emitter radium-223 and survival in metastatic prostate cancer.
New Engl J Med 2013,
369, 213-223
O. Sartor et al., “Lutetium-177-PSMA-617 for Metastatic Castration-Resistant Prostate Cancer.,” NEJM, vol. 385, no. 12, pp. 1091–1103, 2021.
Leitlinienprogramm Onkologie (DGU, Deutsche Krebsgesellschaft, Deutsche Krebshilfe): Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms https://www.leitlinienprogramm-onkologie.de/leitlinien/prostatakarzinom/
Wein, A. J.; Kavoussi, L. R.; Partin, A. P. & Peters, C. A.
Campbell-Walsh Urology
. Elsevier, 2015. ISBN 978-1455775675.
F. Saad et al., “PROpel: Phase III trial of olaparib (ola) and abiraterone (abi) versus placebo (pbo) and abi as first-line (1L) therapy for patients (pts) with metastatic castration-resistant prostate cancer (mCRPC).,” Journal of Clinical Oncology, vol. 40, no. 6suppl, p. 11, 2022.
Saad, F.; Gleason, D. M.; Murray, R.; Tchekmedyian, S.;
Venner, P.; Lacombe, L.; Chin, J. L.; Vinholes, J. J.; Goas, J. A. &
Zheng, M.
Long-term efficacy of zoledronic acid for the prevention of
skeletal complications in patients with metastatic hormone-refractory
prostate cancer
J Natl Cancer Inst, 2004, 96,
879-82
Scher, H. I.; Fizazi, K.; Saad, F.; Taplin, M.;
Sternberg, C. N.; Miller, K.; de Wit, R.; Mulders, P.; Chi, K. N.; Shore,
N. D.; Armstrong, A. J.; Flaig, T. W.; Fléchon, A.; Mainwaring, P.;
Fleming, M.; Hainsworth, J. D.; Hirmand, M.; Selby, B.; Seely, L.; de
Bono, J. S. & Investigators, A. F. F. I. R. M.
Increased survival
with enzalutamide in prostate cancer after chemotherapy.
N Engl J
Med, 2012, 367, 1187-1197.
 English Version: castration-resistant prostate carcinoma
English Version: castration-resistant prostate carcinoma
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.