Sie sind hier: Startseite > Harnblase > Harnblasenkarzinom > operative Therapie
Harnblasenkarzinom: Operative Therapie und Instillationstherapie
- Harnblasenkarzinom: Ursache
- Harnblasenkarzinom: Pathologie
- Harnblasenkarzinom: Klinik und Diagnose
- Harnblasenkarzinom: operative Therapie
- Harnblasenkarzinom: Chemotherapie und Prognose
Therapie des Harnblasenkarzinoms: Übersicht der Behandlungsstrategie
Eine Zusammenfassung der Behandlungsstrategie ist im Flussdiagramm der Abb. Therapieübersicht des Harnblasenkarzinoms dargestellt.
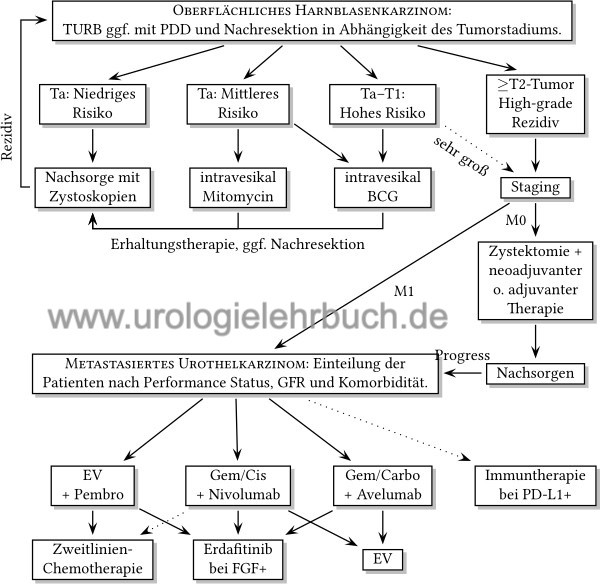 |
Oberflächliches Harnblasenkarzinom:
TURB der kompletten Tumormanifestation, 1× Mitomycin intravesikal, Nachresektion der Narbe in sechs Wochen, zystoskopische Nachsorgen. Kleine unilokuläre Ta low-grade Tumoren müssen nicht nachreseziert werden, es genügen zystoskopische Nachsorgen.
Lokal nicht beherrschbarer Tumor:
Radikale Zystektomie.
Adjuvante intravesikale Therapie:
Je nach Risikoprofil [Tab. einfache Risikozuordnung des Harnblasenkarzinoms, Rezidivscore und Tab. Progressionsrisiko] wird eine adjuvante intravesikale Therapie mit Mitomycin C oder BCG angeschlossen. Bei einem Tumor mit hohem Risiko folgt nach dem ersten Zyklus eine photodynamische Diagnostik mit Quadrantenbiopsie.
Bei negativer Histologie:
Intravesikale Erhaltungstherapie.
Bei low-grade Rezidiv:
Weitere intravesikale Chemotherapie und Nachresektionen.
Bei high-grade Rezidiv:
Radikale Zystektomie.
HarnblasenkarzinomT2–4 M0:
Radikale Zystektomie. Bei fortgeschrittenem Harnblasenkarzinom neoadjuvante Chemotherapie erwägen.
Nach Zystektomie mit R0, N0, M0:
Regelmäßige Tumornachsorge.
Nach Zystektomie mit R1, N+ oder ab T3b:
Adjuvante Chemotherapie oder Immuntherapie erwägen. Engmaschige Tumornachsorge.
Urothelkarzinom der Prostata:
Radikale Zystoprostatektomie mit Urethrektomie. Eine orthotope Neoblase ist nicht möglich.
Harnblasenkarzinom mit panurothelialem Befall:
Radikale Zystektomie mit weiter Resektion des oberen Harntrakts (pyelo-intestinale Anastomose), endoskopische Therapie der Rezidive des oberen Harntrakts, falls möglich.
Alternativen zur Zystektomie:
Insbesondere bei Patienten mit hohem Operationsrisiko.
T2 lokalisiert im Blasendach:
Partielle Zystektomie mit pelviner Lk-Dissektion möglich.
Radikale TURB in zweiter Sitzung:
Wenn Nachresektion ohne Tumor engmaschige Kontrollen, bei Residualtumor Zystektomie.
Radiochemotherapie:
Radikale TURB mit adjuvanter Radiochemotherapie, bei Rezidiv in den Nachsorgen sollte eine Zystektomie durchgeführt werden.
Harnblasenkarzinom mit Fernmetastasen:
Erstlinientherapie mit Enfortumab-Vedotin + Pembrolizumab (EV+P), Zweitlinientherapie mit platinhaltiger Chemotherapie, Immun-Checkpoint-Inhibitoren oder Erdafitinib.
Transurethrale Resektion der Harnblase (TURB)
Die TURB ist die initiale Therapieform aller Harnblasentumoren. Die Infiltrationstiefe und die histologische Differenzierung können relativ genau diagnostiziert werden, weitere Therapieschritte werden in Abhängigkeit dieser Ergebnisse geplant (s. o.). Wichtig ist eine gute Technik bei der Gewinnung des Präparates, damit die Infiltrationstiefe genau bestimmt werden kann. Es besteht die Gefahr des Understaging bei oberflächlichen Harnblasentumoren durch eine zu geringe Schnitttiefe. Die Resektion sollte die Entfernung der kompletten Tumormanifestation erreichen.
Nachresektion:
Patienten mit kleinen, einzelnen, nichtinvasiven und gut differenzierten Harnblasenkarzinom (Ta low-grade) sind nach der kompletten TURB ausreichend therapiert und können mit Zystoskopie nachgesorgt werden. Bei großen oder multilokulären Harnblasenkarzinomen Ta low-grade, T1 oder high-grade Tumoren ist die erneute Resektion der Narben innerhalb von 6 Wochen indiziert.
Photodynamische Diagnostik:
Die Fluoreszenz-Zystoskopie mit Blaulicht nach vorheriger Instillation von Hexaminolevulinat (Hexvix) führt zur besseren Detektion des Harnblasenkarzinoms, insbesondere von flachen Läsionen wie das CIS (Jocham u.a., 2005). Durchführung siehe transurethrale Resektion der Harnblase.
En-bloc Resektion:
Die en-bloc Resektion gelingt mit einem monopolaren Haken, mit der Schlinge oder mit Lasertechnik. Sie bietet den Vorteil der verminderten Tumorzellaussaat und verbessert die pathologische Untersuchung, vergleichende Studien fehlen.
Frühinstillation nach TURB:
Die Frühinstillation mit Mitomycin C nach Resektion eines papillären Harnblasentumors (Single-Shot Gabe perioperativ) reduziert die Rezidivrate um 40% (Sylvester u.a., 2004). Dosierung: 40 mg intravesikal post-OP einmalig, Einwirkzeit 2 h. Kontraindikationen: dauerspülpflichtige Nachblutung, Harnblasenperforation.
Intravesikale Instillationstherapie
Bei oberflächlichen Blasentumoren kann durch eine intravesikale Therapie gesichert die Rezidivhäufigkeit und wahrscheinlich auch die Progressionsrate gesenkt werden. Eine einfache Risikozuordnung gelingt mit Tab. einfache Risikozuordnung des Harnblasenkarzinoms. Genauer kann das Risiko des Rezidivs und der Progression mit der EORTC-Klassifizierung ermittelt werden (Tab. Rezidivscore und Tab. Progressionsrisiko). Bei mittlerem und hohem Rezidivrisiko oder mittlerem Progressionsrisiko kann Mitomycin C oder BCG als intravesikale Therapie gewählt werden. Bei hohem Progressionsrisiko sollte BCG als effektivere Substanz gewählt werden. Bei jungen Patienten ist die frühzeitige Zystektomie eine sinnvolle Therapiealternative.
| Risikofaktor | Rezidivscore | Progressionsscore |
| Tumoranzahl | ||
| 1 | 0 | 0 |
| 2–7 | 3 | 3 |
| ≥8 | 6 | 3 |
| Tumorgröße | ||
| <3 cm | 0 | 0 |
| ≥3 cm | 3 | 3 |
| Tumorezidivrate | ||
| Erstbefund | 0 | 0 |
| ≤ 1 Rezidiv/Jahr | 2 | 2 |
| >1 Rezidiv/Jahr | 4 | 2 |
| T-Stadium | ||
| Ta | 0 | 0 |
| T1 | 1 | 4 |
| begleitendes CIS | ||
| ohne CIS | 0 | 0 |
| mit CIS | 1 | 6 |
| Grading | ||
| G1 | 0 | 0 |
| G2 | 1 | 0 |
| G3 | 2 | 5 |
| Rezidivrisiko | 1 Jahr [%] | 5 Jahre [%] |
| Niedrig (0 Punkte) | 15 | 31 |
| Intermediär (1–4 Punkte) | 24 | 46 |
| Intermediär (5–9 Punkte) | 38 | 62 |
| Hoch (10–17 Punkte) | 61 | 78 |
| Progressionsrisiko | 1 Jahr [%] | 5 Jahre [%] |
| Niedrig (0 Punkte) | 0,2 | 0,8 |
| Intermediär (2–6 Punkte) | 1 | 6 |
| Intermediär (7–13 Punkte) | 5 | 17 |
| Hoch (14–23 Punkte) | 17 | 45 |
Bacillus Calmette-Guerin (BCG):
Der abgeschwächte Stamm von Mycobacterium bovis führt zu einer lokalen Entzündungsreaktion. Die Immunreaktion hat antikanzerogenen Effekt.
Indikation zur BCG-Therapie:
BCG ist indiziert zur intravesikalen Immuntherapie des oberflächlichen Harnblasenkarzinoms mit mittlerem und hohem Risiko, siehe Tab. Rezidivscore und Tab. Rezidivrisiko. Die BCG-Immuntherapie ist effektiver als die Mitomycin C-Instillation, nachteilig ist jedoch die hohe Nebenwirkungsrate.
Dosierung von BCG:
2×108 bis 3×109 Bakterien in 50 ml NaCl intravesikal per Einmalkatheter einmal wöchentlich über 6 Wochen. Um eine lange Einwirkzeit von 2 h zu erreichen, sollte der Patient vor Instillation nur wenig trinken. Nach dem sechswöchigem Behandlungszyklus und sechs Wochen Pause sollte eine Nachresektion und Quadrantenbiopsie durchgeführt werden. Bei erfolgreicher intravesikaler Chemotherapie ist eine Erhaltungstherapie sinnvoll: drei Instillationen im wöchentlichen Abstand in den Monaten 3, 6, 12, 18, 24, 30 und 36. Bei einem high-grade Rezidiv sollte die Zystektomie angestrebt werden, alternativ kann bei hohem OP-Risiko ein zweiter Zyklus BCG versucht werden.
Nebenwirkungen von BCG:
Pollakisurie und Dysurie häufig, hämorrhagische Zystitis 7 %, metastatische Infektion 2 % bis zur BCG-Sepsis (sehr selten). Die Nebenwirkungen führen nicht selten zu Therapieabbrüchen. Therapie bei Nebenwirkungen: Isoniazid, bei schwerer systemischer Infektion in Kombination mit Rifampicin.
Wirksamkeit und Prognose von BCG:
Bei oberflächlichen high-grade Tumoren ist eine dauerhafte Remission in ungefähr 50–70 % erreichbar. BCG reduziert das Rezidivrisiko um ungefähr 50 % gegenüber einer alleinigen TURB.
Mitomycin C:
Die intravesikale Chemotherapie mit Mitomycin C ist besser verträglich als BCG, sie ist bei Tumoren mit intermediärem Rezidivrisiko oder Progressionsrisiko eine Therapieoption anstatt BCG. Dosierung: 20–40 mg Mitomycin C intravesikal pro Woche (6 Instillationen), dann monatliche Gaben (11 Instillationen).
Hypertherme intravesikale Chemotherapie (HIVEC):
Die Applikation von Mitomycin C mit einer Temperatur von 43 Grad Celsius steigert die Effektivität der Substanz und kann auch als Alternative zu BCG angesehen werden (Vartolomei u.a. ,2022). Nachteilig sind die Kosten für Geräte und Einwegmaterial für die Applikation.
Epirubicin oder Doxorubicin:
Alternativen zu BCG oder Mitomycin C zur intravesikalen Therapie bei oberflächlichen Hochrisiko-Harnblasenkarzinomen. Wirkmechanismus der Antrazykline: Interaktion mit der DNA und RNA führt zu deren Synthesestörung und Strangabbrüchen.
Gemcitabin:
Gemcitabin wird (Off-label für die intravesikale Anwendung in Europa) zur Therapie des oberflächlichen Harnblasenkarzinoms nach Versagen von BCG angewendet. Gemcitabin wird auch teilweise mit Docetaxel kombiniert. In den USA gibt es seit 2025 eine Zulassung für ein intravesikales Applikationssystem von Gemcitabin (Inlexzo), das über drei Wochen den Wirkstoff freigibt (Daneshmand et al., 2025).
Radikale Zystektomie
Indikationen zur Zystektomie:
Harnblasenkarzinom mit Tumorstadium größer als T1, oberflächliches high-grade Harnblasenkarzinom mit hohem Progressionsrisiko [Tab. Rezidivscore und Tab. Rezidivrisiko] bei jungen Patienten (frühelektive Zystektomie), Rezidiv eines Rezidiv eines oberflächlichen high-grade Tumors, endoskopisch nicht beherrschbares oberflächliches Karzinom, Schrumpfblase nach intravesikaler Chemotherapie, palliativ bei metastasiertem Urothelkarzinom.
Technik der Zystektomie und Harnableitung:
Entfernung der Harnblase mit Sicherheitsabstand und Durchführung einer pelvinen Lymphadenektomie. Beim Mann enthält das pathologische Präparat die Harnblase, Prostata, die Samenblasen, die Ampullae der Ducti deferentes und die distalen Ureteren. Bei der Frau enthält das pathologische Präparat die Harnblase, die distalen Ureteren, ein Teil der vaginalen Vorderwand, Uterus und in Abhängigkeit des Alters die Ovarien und Eileiter. Die Technik der Zystektomie ist bei Mann und Frau unterschiedlich:
Lymphadenektomie im Rahmen der radikalen Zystektomie:
Die Dissektionsgrenzen für die Standardlymphadenektomie sind lateral der N. genitofemoralis, kaudal der Ramus superior des Os pubis, medial das Lig. umbilicale und die Harnblase, in der Tiefe der N. obturatorius und die Beckenwand, kranial der Ureter und die Gabelung der A. iliaca communis. In zwei prospektiv randomisierten Studien konnte durch eine extendierte Lymphadenektomie keine Verbesserung des Überlebens erreicht werden (Gschwend u.a., 2019a).
Alternative Zystektomietechniken:
Um sexuelle Nebenwirkungen und Harninkontinenz zu vermeiden, wurden sowohl bei der Frau (Koie u.a., 2010) als auch beim Mann (Mertens u.a., 2014) technische Modifikationen publiziert. Bei der Frau führt der Erhalt der vaginalen Vorderwand und des Uterus zu einem besseren Sexualleben und Kontinenz nach der OP. Beim Mann führt der Erhalt der Prostatakapsel zu einer besseren Schonung von Schließmuskel und Nn. cavernosi, dies verbessert ebenfalls die Kontinenz und die erektile Funktion. Eine sorgfältige Selektion der Patienten im Abhängigkeit des intravesikalen Tumorwachstums ist elementar für den onkologischen Erfolg. Das Trigonum und die prostatische Harnröhre sollten ohne Tumorbefall sein, vor Anwendung o.g. Techniken sollten gezielte Biopsien präoperativ durchgeführt werden.
Onkologische Ergebnisse nach Zystektomie:
Siehe unten unter Harnblasenkarzinom Prognose.
Neoadjuvante oder adjuvante Chemotherapie und Zystektomie:
Mehrere Studien belegen die verlängerte Überlebenszeit bei neoadjuvanter als auch adjuvanter Chemotherapie, in Metaanalysen verbessern beide Verfahren die 5JÜR um 5–6% (Burdett u.a., 2022). Indikationen sind organüberschreitendes Wachstum oder Lymphknotenmetastasen präoperativ in der Bildgebung oder eine entsprechende Histologie postoperativ. Manche Autoren empfehlen die (neo)adjuvante Chemotherapie für alle Patienten mit muskelinvasivem Harnblasenkarzinom.
Dosierung: neoadjuvant werden 2–4 Zyklen MVAC oder Gemcitabin/Cisplatin verabreicht, die weitere postoperative Chemotherapie entscheidet sich in Abhängigkeit der Histologie und Ansprechen. Als adjuvante Chemotherapie werden nach Zystektomie mit hoher Rezidivwahrscheinlichkeit 4 Zyklen veranschlagt.
Adjuvante Immuntherapie:
Die adjuvante Immuntherapie mit Nivolumab verbessert nach Zystektomie das progressionsfreie Überleben: 21 Monate (Nivolumab) vs. 11 Monate (Placebo) mittleres progressionsfreies Überleben (Bajorin u.a., 2021). Nivolumab ist bei Pat. mit hohem Rezidivrisiko (pT3–4 oder pTN+) und Tumorzell-PD-L1-Expression ≥1% für die adjuvante Therapie seit 2022 in Europa zugelassen.
Die adjuvante Immuntherapie mit Atezolizumab konnte keine Verbesserung des progressionsfreien Überleben zeigen (Bellmunt u.a., 2021), weitere Substanzen befinden sich in der klinischen Prüfung.
Neoadjuvante Strahlentherapie und Zystektomie:
Die neoadjuvante Strahlentherapie wird nicht vor radikaler Zystektomie empfohlen, obwohl einzelne Studien einen positiven Effekt bezüglich der Vermeidung eines Lokalrezidivs zeigen konnten. Die Überlebensrate wird vor allem durch das Auftreten von Fernmetastasen bestimmt, und diese werden durch die Bestrahlung nicht reduziert.
Partielle Zystektomie
Bei lokalisiertem Harnblasenkarzinom mit Muskelinvasion, insbesondere beim Wachstum am Harnblasendach (Urachuskarzinom), ist die partielle Zystektomie mit pelviner Lymphadenektomie eine Therapiealternative zur radikalen Zystektomie. Weiterhin sind auch Harnblasenkarzinome in Harnblasendivertikeln gut geeignet für die Harnblasenteilresektion, dies gilt auch für große oberflächliche Divertikeltumoren. Nachtteilig ist das Risiko des intravesikalen Rezidivs und die damit notwendigen engmaschigen Kontrollen, die zweizeitige radikale Zystektomie bei Tumorprogress ist in bis zu 25% notwendig. Folgende Voraussetzung werden empfohlen, um vergleichbare onkologische Ergebnisse zu erzielen (Capitanio u.a., 2009):
- Solitärer Harnblasentumor
- Ausschluss eines CIS durch Quadrantenbiopsie
- Ausreichend große Harnblasenkapazität, welche eine Resektion mit Sicherheitsabstand von 1–2 cm ermöglicht
Harnblasenerhalt mit Radiochemotherapie
Gewinnt als kombiniertes Therapieschema des Harnblasenkarzinoms kurative Bedeutung: nach einer radikalen TURB folgt eine perkutane Radiatio und Chemotherapie (Cisplatin-haltig). Bei vergleichbaren Tumorstadien und Patientenselektionen werden anscheinend nicht wesentlich schlechtere Ergebnisse im Vergleich zur radikalen Zystektomie berichtet: 5JÜR 48–63 %, 36–43 % Langzeitüberleben ohne Notwendigkeit der Zystektomie.
Nachteilig sind die hohe Nebenwirkungsrate, die Notwendigkeit der aufwendigen interdisziplinären Behandlung und die hohe Rezidivrate an oberflächlichen Tumoren mit anhaltender Notwendigkeit an interventionellen Eingriffen. Ein eindeutiger Vorteil im Bereich der Lebensqualität scheint bei den guten funktionellen Ergebnissen der Neoblase mehr als fraglich.
| Harnblasenkarzinom Diagnose | Suchen | Chemotherapie Harnblasenkarzinom |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur Harnblasenkarzinom
Abol-Enein, H.
Infection: is it a cause of bladder
cancer?
Scand J Urol Nephrol Suppl, 2008, 79-84.
Amin und Young 1997 AMIN, M. B. ; YOUNG, R. H.:
Primary carcinomas of the urethra.
In: Semin Diagn Pathol
14 (1997), Nr. 2, S. 147–60
Babjuk, M.; Burger, M.; Compérat, E.; Gonter, P.;
Mostafid, A.; Palou, J.; van Rhijn, B.; Rouprêt, M.; Shariata, S.;
Sylvester, R. & Zigeuner, R.
Non-muscle-invasive Bladder CancerEAU
Guidelines, 2020 https://uroweb.org/guidelines/non-muscle-invasive-bladder-cancer/
Brinkman, M. & Zeegers, M. P.
Nutrition, total
fluid and bladder cancer.
Scand J Urol Nephrol Suppl, 2008,
25-36.
Cohn, J. A.; Vekhter, B.; Lyttle, C.; Steinberg,
G. D. & Large, M. C.
Sex disparities in diagnosis of bladder cancer
after initial presentation with hematuria: a nationwide claims-based
investigation.
Cancer, 2014, 120, 555-561
Daneshmand S, Van der Heijden MS, et al. TAR-200 for Bacillus Calmette-Guérin-Unresponsive High-Risk Non-Muscle-Invasive Bladder Cancer: Results From the Phase IIb SunRISe-1 Study. J Clin Oncol. 2025 Jul 30:JCO2501651. doi: 10.1200/JCO-25-01651.
DGU; DKG; DKG & Leitlinienprogramm Onkologie S3-Leitlinie (Langfassung): Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms. https://www.leitlinienprogramm-onkologie.de/leitlinien/harnblasenkarzinom/
J. E. Gschwend et al., “Extended Versus Limited Lymph Node Dissection in Bladder Cancer Patients Undergoing Radical Cystectomy: Survival Results from a Prospective, Randomized Trial.,” Eur Urol, vol. 75, no. 4, pp. 604–611, 2019, doi: 10.1016/j.eururo.2018.09.047.
Helpap und Kollermann 2000 HELPAP, B. ;
KOLLERMANN, J.:
[Revisions in the WHO histological classification of urothelial
bladder tumors and flat urothelial lesions].
In: Pathologe
21 (2000), Nr. 3, S. 211–7
IARC (2004) Monographs on the Evaluation of Carcinogenic Risks to Humans. Volume 83. Tobacco Smoke and Involuntary Smoking. World Health Organization.
Kalble 2001 KALBLE, T.:
[Etiopathology, risk factors, environmental influences and
epidemiology of bladder cancer].
In: Urologe A
40 (2001), Nr. 6, S. 447–50
Kataja und Pavlidis 2005 KATAJA, V. V. ;
PAVLIDIS, N.:
ESMO Minimum Clinical Recommendations for diagnosis, treatment and
follow-up of invasive bladder cancer.
In: Ann Oncol
16 Suppl 1 (2005), S. i43–4
Krieg und Hoffman 1999 KRIEG, R. ; HOFFMAN, R.:
Current management of unusual genitourinary cancers. Part 2: Urethral
cancer.
In: Oncology (Williston Park)
13 (1999), Nr. 11, S. 1511–7, 1520; discussion 1523–4
Lammers, R. J. M.; Witjes, W. P. J.; Hendricksen, K.;
Caris, C. T. M.; Janzing-Pastors, M. H. C. & Witjes, J. A.
Smoking
status is a risk factor for recurrence after transurethral resection of
non-muscle-invasive bladder cancer.
Eur Urol, 2011,
60, 713-720
Lampel und Thuroff 1998a LAMPEL, A. ;
THUROFF, J. W.:
[Bladder carcinoma 1: Radical cystectomy, neoadjuvant and adjuvant
therapy modalities].
In: Urologe A
37 (1998), Nr. 1, S. 93–101
Lampel und Thuroff 1998b LAMPEL, A. ;
THUROFF, J. W.:
[Bladder carcinoma. 2: Urinary diversion].
In: Urologe A
37 (1998), Nr. 2, S. W207–20
Leppert u.a. 2006 LEPPERT, J. T. ; SHVARTS,
O. ; KAWAOKA, K. ; LIEBERMAN, R. ; BELLDEGRUN,
A. S. ; PANTUCK, A. J.:
Prevention of bladder cancer: a review.
In: Eur Urol
49 (2006), Nr. 2, S. 226–34
Liu, S.; Yang, T.; Na, R.; Hu, M.; Zhang, L.; Fu,
Y.; Jiang, H. & Ding, Q.
The impact of female gender on bladder
cancer-specific death risk after radical cystectomy: a meta-analysis of
27,912 patients.
International urology and nephrology, 2015,
47, 951-958
Michaud u.a. 1999 MICHAUD, D. S. ; SPIEGELMAN,
D. ; CLINTON, S. K. ; RIMM, E. B. ; CURHAN,
G. C. ; WILLETT, W. C. ; GIOVANNUCCI, E. L.:
Fluid intake and the risk of bladder cancer in men.
In: N Engl J Med
340 (1999), Nr. 18, S. 1390–7
Plna und Hemminki 2001 PLNA, K. ; HEMMINKI, K.:
Familial bladder cancer in the National Swedish Family Cancer
Database.
In: J Urol
166 (2001), Nr. 6, S. 2129–33
Rajan u.a. 1993 RAJAN, N. ; TUCCI, P. ;
MALLOUH, C. ; CHOUDHURY, M.:
Carcinoma in female urethral diverticulum: case reports and review of
management.
In: J Urol
150 (1993), Nr. 6, S. 1911–4
Robert-Koch-Institut (2015) Krebs in Deutschland 2011/2012. www.krebsdaten.de
Stein u.a. 2001 STEIN, J. P. ; LIESKOVSKY,
G. ; COTE, R. ; GROSHEN, S. ; FENG, A. C. ;
BOYD, S. ; SKINNER, E. ; BOCHNER, B. ;
THANGATHURAI, D. ; MIKHAIL, M. ; RAGHAVAN, D. ;
SKINNER, D. G.:
Radical cystectomy in the treatment of invasive bladder cancer:
long-term results in 1054 patients.
In: J Clin Oncol
19 (2001), Nr. 3, S. 666–75
Weissbach 2001 WEISSBACH, L.:
[Palliation of urothelial carcinoma of the bladder].
In: Urologe A
40 (2001), Nr. 6, S. 475–9
Witjes, J.; Compérat, E.; Cowan, N.; Gakis, G.;
Hernánde, V.; Lebret, T.; Lorch, A.; van der Heijden, A. & Ribal, M.
Muscle-invasive
and Metastatic Bladder Cancer
EAU Guidelines, 2020 https://uroweb.org/guidelines/bladder-cancer-muscle-invasive-and-metastatic/
 English Version: Surgical treatment (TURB and cystectomy) of bladder cancer
English Version: Surgical treatment (TURB and cystectomy) of bladder cancer
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.