Sie sind hier: Startseite > Hoden > Hodentumoren > Ursachen
Hodentumor (Keimzelltumoren): Ursachen und Pathologie
- Hodentumor: Ursachen und Pathologie
- Hodentumor: Tumorstadien und Klinik
- Hodentumor: Diagnose
- Hodentumor: Therapie der Seminome
- Hodentumor: Therapie der Nichtseminome, Prognose
Definition der Hodentumoren
Keimzelltumoren sind das häufigste Malignom des jungen Mannes, sie gehen vom germinativen Epithel des Hodens aus oder seltener von versprengten embryonalen Keimzellen EAU Guidelines Testicular Cancer, Deutsche Leitlinien (DGU u.a.).
Epidemiologie der Hodentumoren
Krebsstatistik:
Zwischen dem 20. und 44. Lebensjahr ist der maligne Hodentumor die häufigste Krebserkrankung des Mannes (Anteil 25%). Insgesamt ist der Hodentumor mit 1–2 % aller Tumorerkrankungen selten. Das Lebenserkrankungsrisiko beträgt ungefähr 0,4 %.
Inzidenz:
10 pro 100.000 Einwohnern in Deutschland, steigende Inzidenz. 2018 erkrankten in Deutschland 4160 Männer und 178 starben an einem Keimzelltumor. Dies entspricht einer Mortalität von 0,4 pro 100000 (RKI, 2021).
Hodentumoren bei Kindern:
Hodentumoren bei Kindern sind sehr selten (0,2 pro 100000 Einwohnern in Europa), meist benigne und haben in der Regel keinen Bezug zur einer Keimzellneoplasie in situ (siehe Pathologie): u.a. Teratom, Dottersacktumor oder Stromatumoren.
Pathogenese und Risikofaktoren von Hodentumoren
Pathogenese:
Der Keimzelltumor entsteht durch eine fehlerhafte Reifung der primordialen Keimzelle und damit verbundener ungehemmter Zellteilung und Vermehrung. Die transformierten Keimzellen sind zunächst basal in den Tubuli seminiferi lokalisiert und verdrängen dort die Spermatogenese. Diese Läsionen werden nach aktueller Nomenklatur in situ Keimzellneoplasie oder nicht-invasive Keimzellneoplasie genannt, engl. germ cell neoplasia in situ (GCNIS). Die GCNIS ruht zunächst, i.d.R. erst nach der Pubertät kommt es zur weiteren Proliferation und Bildung von Seminomen und Nichtseminomen. Molekulare Ursachen der Tumorprogression wurden teilweise identifiziert: Überexpression von p53, Nachweis überzähliger Kopien des Isochromosoms i(12p), Verlust der Expression von c-Kit und Deregulation des Zellzyklus am G1/S Checkpoint.
Keimzelltumoren ohne GCNIS:
Keimzelltumoren ohne GCNIS-Vorläufer sind selten und typisch für Tumoren in der Präpubertät (Teratom, Dottersacktumor) und bei Männern höheren Alters (spermatozytische Seminom).
Risikofaktoren:
Angeborene Eigenschaften des Keimepithels (polygenes Pathogenese) und Umwelteinflüsse fördern die maligne Entartung des Keimepithels.
Kryptorchismus:
Die Gefahr der Tumorentwicklung ist 10–20 mal größer als beim normal deszendierten Hoden, je höher die Hodenlokalisation desto größer das Tumorrisiko. Die frühe Orchidopexie reduziert das Tumorrisiko und ermöglicht klinische Kontrollen zur Früherkennung [siehe Abschnitt Kryptorchismus].
Familiäre Belastung:
Doppeltes relatives Risiko bei der Erkrankung des Vaters, vierfaches Risiko bei Erkrankung des Bruders und bis zu 20faches Risiko bei Erkrankung eines Zwillingsbruders (Kharazmi u.a., 2015). Die Datenlage spricht für ein polygenes Pathogenesemodell, bei dem mehrere Gene mit geringer Penetranz die Erkrankung auslösen.
Kontralateraler Hodentumor:
Innerhalb von 15 Jahren entsteht in 2% ein kontralateraler Hodentumor, das entspricht einem 12fachen relativen Risiko (Travis u.a., 2010).
Ethnische Zugehörigkeit:
Etwa 4fach häufigeres Vorkommen bei weißen Männern in den USA im Vergleich zu schwarzen Männern.
Umweltgifte:
Die steigende Inzidenz in Industrienationen spricht für Umweltgifte, welche neben Hodentumoren auch das Risiko für andere Krankheiten erhöhen (Infertilität, Kryptorchismus, Hypospadie, Frühgeburten). Als Auslöser werden zahlreiche Stoffe (endokrine Disruptoren) in Kunststoffen und Pestiziden diskutiert (DeToni u.a., 2019) (Rodprasert u. a., 2021).
Weitere Risikofaktoren:
Testikuläre Mikrolithiasis (Sternenhimmel), Infertilität, Diethylstilbestrol in der Schwangerschaft, Cannabiskonsum (umstritten), Mumpsorchitis (umstritten).
Pathologie der Hodentumoren
Einteilung nach WHO 2016:
Die Einteilung der WHO unterscheidet zwischen Keimzelltumoren ausgehend von einer nicht-invasiven Keimzellneoplasie (GCNIS) und Keimzelltumoren ohne Bezug zu GCNIS (Moch u.a., 2016).
- Keimzelltumoren ausgehend von einer Keimzellneoplasie in situ
- nicht-invasive Keimzellneoplasie (GCNIS)
- Seminome
- Nichtseminome
- Embryonales Karzinom
- Dottersacktumor vom postpubertären Typ
- Teratom
- Teratom mit maligner somatischer Transformation
- Trophoblastische Tumoren: Chorionkarzinom, trophoblastischer Plazentatumor u.a. mehr
- Tumoren aus mehreren histologischen Typen: Keimzellmischtumoren
- Keimzelltumoren ohne Bezug zu einer Keimzellneoplasie in situ
- Spermatozytischer Tumor
- Teratome vom präpubertären Typ: u.a. Dermoidzyste, Epidermoidzyste.
- Dottersacktumoren vom präpubertären Typ
- Keimstrang- und Stromatumoren
- Leydigzell-Tumor
- Sertolizell-Tumor
- Granulosazell-Tumor
- Gemischte und entdifferenzierte Formen: u.a. Androblastom
- Tumoren mit Keimzell- und Keimstranganteilen: Gonadoblastom
Nicht-invasive Keimzellneoplasie:
Engl. germ cell neoplasia in situ (GCNIS). Ehemalige Bezeichungen: Carcinoma in situ des Keimzelltumors (CIS). Testikuläre intraepitheliale Neoplasie (TIN). Die GCNIS ist im ganzen Hoden verbreitet, es genügt für den Nachweis ein kleiner Anteil von Hodenparenchym (3 mm Durchmesser oder Nadelbiopsie). Bei Nachweis einer GCNIS entsteht innerhalb von 5 Jahren in 50% eine Progression zu einem invasivem Keimzelltumor. Risikofaktoren für das Vorliegen einer GCNIS im kontralateralen tumorfreien Hoden: Hodenatrophie, Kryptorchismus, Alter unter 30 Jahre.
Seminome:
40–55 % der Hodentumoren. Sehr selten im Kindesalter, typischerweise Auftreten zwischen 30–50 Lebensjahren, aber auch über 60 Jahre vorkommend. In 10–20 % ist die Produktion von HCG vorhanden, die Freisetzung von AFP schließt ein Seminom aus.
Makroskopie: weißliche gut abgegrenzte nicht abgekapselte Tumoren mit gelegentlichen Einblutungen und Nekrosen [Abb. 2.7].
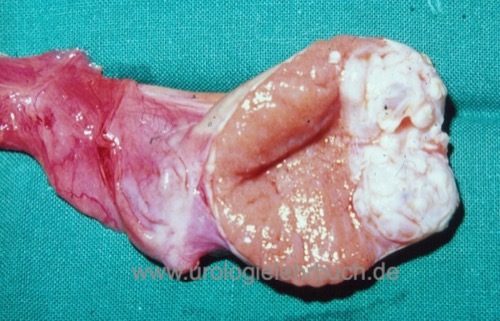 |
Klassisches Seminom:
80–85 % der Seminome, in 10–15 % mit synzytiotrophoblastären Elementen und dann auch mit HCG-Produktion einhergehend. Relativ langsames Wachstum, ein retroperitoneales Rezidiv kann bis zu 2–10 Jahre nach Therapie auftreten.
Anaplastisches Seminom:
5–10 % der Seminome, aber für 30 % der Todesfälle bei Seminomen verantwortlich. Pathologisch sind viele Kriterien der hohen Malignität nachweisbar: Mitoseindex, nukleärer Pleomorphismus, schnellere Invasion und Metastasierung. Bei gleichem Tumorstadium ist jedoch die gleiche Prognose wie beim klassischen Seminom zu erwarten.
Spermatozytischer Tumor:
1% der Keimzelltumoren, meist bei Männern über 50 Jahren. Früher den Seminomen zugeordnet, gilt der spermatozytischer Tumor nun als eigene Entität. Die Tumorzellen ähneln reifenden Spermatogonien und zeigen keinen Bezug zu einer Keimzellneoplasie in situ. Es besteht ein sehr geringes Metastasierungspotential und damit eine exzellente Prognose.
Sehr selten können bei spermatozytischen Tumoren auch sarkomatöse Anteile nachgewiesen werden. Dies ist ein Zeichen für einen hochaggressiven Tumor mit schlechter Prognose, eine multimodale Therapie ist notwendig (RLA, Chemo, Radiatio).
Nichtseminome:
40–60 % der Hodentumoren. , sie bestehen aus unten genannten Gewebetypen, welche einzeln oder in unterschiedlichsten Kombinationen vorkommen.
Embryonales Karzinom (30–50 %):
Grau-weißer fleischiger Tumor mit Einblutungen, Zysten und Nekrosen. Histologisch besteht ein epithelialer Charakter. Serologisch sind AFP und HCG fakultativ erhöht.
Chorionkarzinom (5–10 %):
Histologisch besteht ein plazentaähnlicher Aufbau (Synzytio- und Zytotrophoblasten). Typisch ist die fortgeschrittene Metastasierung bei kleinem Primärtumor. HCG ist typischerweise extrem erhöht, AFP fakultativ positiv.
Teratom (30–50 %):
Histologisch gegliedert in reifes Teratom, unreifes Teratom oder Teratom mit maligner somatischer Transformation. Teratome führen nicht zur einer Erhöhung der Tumormarker AFP oder HCG.
Bei reifen Teratomen finden sich ausdifferenzierte Strukturen der drei Keimblätter (Endoderm, Mesoderm und Ektoderm). Bei unreifen Teratomen findet sich Gewebe, welches den fetalen Entwicklungsstufen der drei Keimblätter ähnelt. In selten Fällen durchläuft das Teratom eine maligne somatische Transformation, es entstehen Sarkome, primäre neuroektodermale Tumoren (PNET) oder Karzinome. Teratome mit maligner somatischer Transformation können metastasieren und sprechen schlecht auf eine Chemotherapie an (Giannatempo u.a., 2016).
Dottersacktumor (5–10 %):
Häufigster Tumor bei Kindern unter 3 Jahren. Veraltete Synonyme: entodermaler Sinustumor, infantiles embryonales Karzinom, Orchioblastom.
AFP ist erhöht, das HCG ist nicht erhöht.
Mischtumoren (10–30 %):
Der Mischtumor enthält variable Anteile von Seminom und Nichtseminomen. Die Therapie richtet sich nach den Richtlinien für Nichtseminome.
Lymphogene Metastasierung:
Keimzelltumoren metastasieren lymphogen mit hoher Wahrscheinlichkeit zunächst in die retroperitonealen Lymphknoten. Rechtsseitige Tumoren neigen eher als linksseitige zur Metastasierung in das kontralaterale Retroperitoneum. Im weiteren Verlauf metastasieren Keimzelltumoren entlang der Lymphbahnen weiter nach kranial in die retrokruralen und supradiaphragmalen Lymphknoten.
Die Lymphdrainage fast ausnahmslos in die retroperitonealen Lymphknoten ist durch den Hodendeszensus erklärt. Als Ausnahme ist der zerstörte Lymphabfluss nach Trauma oder Voroperation zu nennen, die Lymphknotenmetastasierung ist dann zusätzlich in die pelvinen und inguinalen Lymphknoten möglich.
Risikofaktoren für eine lymphogene Metastasierung:
Invasion von Lymphgefäßen des Primärtumors. Zusätzlich beim Seminom sind die Größe des Primärtumors (> 4 cm) und die Invasion des Rete testis Risikofaktoren für retroperitoneale Lymphknotenmetastasen.
Hämatogene Metastasierung:
Sie tritt im Krankheitsverlauf deutlich später als die lymphogene Metastasierung auf. Im Krankheitsstadium pN0 liegt die Wahrscheinlichkeit von bereits vorliegenden hämatogenen Metastasen bei 5–8 %. Risikofaktoren für eine hämatogene Metastasierung sind eine vaskuläre Invasion des Primärtumors.
| Testosteronmangel | Suchen | Hodentumor Stadien |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Albers, P.; Albrecht, W.; Algaba, F.; Bokemeyer,
C.; Cohn-Cedermark, G.; Fizazi, K.; Horwich, A.; Laguna, M.; Nicolai, N. &
Oldenburg, J.
EAU Guidelines: Testicular Cancer
. https://uroweb.org/guidelines/testicular-cancer/
DGU, DKG, AWMF, and L. Onkologie, “S3-Leitlinie Diagnostik, Therapie und Nachsorge der Keimzelltumoren des Hodens. Langversion 1.1.” [Online]. Available: https://www.leitlinienprogramm-onkologie.de/leitlinien/hodentumoren/
A. Stephenson, E. B. Bass, and B. R. Bixler, “Diagnosis and Treatment of Early-Stage Testicular Cancer: AUA Guideline.” [Online]. Available: https://www.auanet.org/guidelines-and-quality/guidelines/testicular-cancer-guideline
Kharazmi E., Hemminki K., Pukkala E., Sundquist K., Tryggvadottir L., Tretli S., Olsen J.H., and Fallah M. Cancer risk in relatives of testicular cancer patients by histology type and age at diagnosis: a joint study from five nordic countries, Eur Urol 2015, 68(2):283-89.
S. Krege, J. Beyer, R. Souchon, P. Albers, and EGCCCG-Members.
European consensus conference on diagnosis and treatment of germ cell
cancer: a report of the second meeting of the european germ cell cancer
consensus group (egcccg): part i.
Eur Urol, 53 (3): 478–496, Mar
2008a.
S. Krege, J. Beyer, R. Souchon, P. Albers, and EGCCCG-Members.
European consensus conference on diagnosis and treatment of germ cell
cancer: a report of the second meeting of the european germ cell cancer
consensus group (egcccg): part ii.
Eur Urol, 53 (3): 497–513, Mar
2008b.
Robert-Koch-Institut
Krebs in Deutschland 2017/2018
2021 https://www.krebsdaten.de/
W. Rodprasert, J. Toppari, and H. E. Virtanen, “Endocrine Disrupting Chemicals and Reproductive Health in Boys and Men.,” Front Endocrinol., vol. 12, p. 706532, 2021.
 English Version: Etiology, Pathology, tumor stages and diagnosis of germ cell tumors (testicular cancer)
English Version: Etiology, Pathology, tumor stages and diagnosis of germ cell tumors (testicular cancer)
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.