Sie sind hier: Startseite > Diagnostik > Blutuntersuchung > Tumormarker PSA
PSA (Prostataspezifisches Antigen): Prostatakarzinom Tumormarker
Das prostataspezifische Antigen (PSA) ist ein Gewebskallikrein (formeller Name: humanes Kallikrein 3 = hK3): Glykoprotein, Molekülmasse 33000 Dalton, 237 Aminosäuren groß. PSA wird in einer inaktiven Vorform in der Drüsenzelle produziert (PreProPSA), durch Abspaltung entsteht das ProPSA (immer noch inaktiv), das in die Samenflüssigkeit sezerniert wird. Durch eine weitere Abspaltung (durch Kallikrein 2, hK2) wird PSA in den Samenwegen aktiviert. PSA ist eine Serinprotease und dient der Samenverflüssigung. (Polascik u.a., 1999).
Vorkommen und Biochemie:
Die Hauptmenge des PSA wird in die Samenflüssigkeit sezerniert, im Blut ist die Konzentration um den Faktor 1000000 kleiner, normalerweise unter 4 ng/ml. In geringsten Konzentrationen und ohne klinische Bedeutung ist PSA auch in der Brust, in der Muttermilch, im Endometrium und in Tumoren von Nieren und Nebennieren nachweisbar.
Aktives PSA wird in den Samenwegen durch Proteolyse zu inaktiven PSA gespalten. Inaktives PSA, das in die Blutbahn gelangt, zirkuliert als freies PSA (fPSA, 10–30%). Aktives PSA, das in die Blutbahn gelangt, wird von Proteaseinhibitoren wie α1-Antichymotrypsin (ACT) oder α2-Makroglobulin (AMG, A2M) durch eine Komplexbildung inaktiviert (cPSA, 70–90%). Das Gesamt-PSA (tPSA für total PSA) kommt daher im Blut als freies PSA (fPSA) und als komplexiertes PSA (cPSA) vor.
Das gebundene PSA wird in der Leber abgebaut, eine glomeruläre Filtration findet aufgrund seiner Größe nicht statt. Die Halbwertszeit beträgt 2–3 Tage. Die Halbwertszeit des freien PSA ist deutlich kürzer, da auch eine glomeruläre Filtration möglich ist (Stephan u.a., 2000).
Indikationen für eine PSA-Bestimmung
Die PSA-Konzentration wird zur Früherkennung des Prostatakarzinoms, als Tumormarker im Verlauf der Prostatakarzinomerkrankung und als Krankheitsmarker der Prostata (z.B. bei Infektionen) verwendet (Cuzick u.a., 2014).
Tumormarker:
Früherkennung, Prognoseparameter und Tumornachsorge beim Prostatakarzinom.
Krankheitsmarker:
Nachweis und Verlaufsparameter der bakteriellen Prostatitis, Progressionsmarker der benignen Prostatahyperplasie (BPH).
Messmethoden des prostataspezifischen Antigens (PSA):
Das PSA-Molekül besitzt fünf Epitope, die teilweise durch eine Proteinbindung verdeckt werden oder erst nach Inaktivierung zugänglich werden. Dies ermöglicht die Messung von tPSA, fPSA und cPSA mit Hilfe entsprechender Antikörper. Als Messmethode wird meist ein Sandwich-ELISA angewendet. Semiquantitative Teststreifenverfahren sind für die Früherkennung des Prostatakarzinoms ungeeignet, werden aber kommerziell angeboten.
PSA-Grenzwert bei Vorsorgen
1 g Prostatagewebe erhöht das PSA um bis zu 0,15 ng/ml, während Prostatakarzinomgewebe etwa die 10–30fache PSA-Menge freisetzt. Aufgrund der erheblichen Unterschiede in der Gewebemenge zwischen BPH (viele Gramm) und Prostatakarzinom (wenige Gramm) sind Grenzwerte (Normalwerte) nicht in der Lage, zwischen einem PCA oder einer BPH zu differenzieren. Früher wurde ein starrer PSA-Grenzwert von 4 ng/ml zur Indikationsstellung für eine Prostatabiopsie verwendet. Ein starrer Grenzwert führte jedoch zu einer schlechten Vorhersagegenauigkeit des PSA, was zu unnötigen Prostatabiopsien und übersehenen Prostatakarzinomen führte.
Die Vorhersagegenauigkeit des PSA kann durch die kombinierte Betrachtung von altersabhängigen Grenzwerten, der Anstiegsgeschwindigkeit (PSA-Velocity) und des freien PSA (fPSA) verbessert werden. Ein erhöhter PSA-Wert sollte unter Berücksichtigung von Störfaktoren kontrolliert werden. Zusätzlich muss die PSA-Konzentration in Abhängigkeit von weiteren klinischen Variablen interpretiert werden (Tastuntersuchung, Alter, Familienanamnese, Bildgebung). So können unnötige Stanzbiopsien vermindert werden und die Detektion eines Prostatakarzinoms wird verbessert.
Falsch-negativer PSA-Test:
Bei einem falsch-negativen PSA-Test liegt die PSA-Konzentration im Normbereich, trotzdem liegt ein Prostatakarzinom vor. Ursachen sind nicht PSA-exprimierende Prostatakarzinome, eine antiandrogene Therapie, Finasterid und Dutasterid. Eine Therapie mit Finasterid über 12 Monate führt zu einer Halbierung der PSA-Konzentration (Guess u.a., 1993). Weitere Ursachen falsch-niedriger PSA-Konzentrationen sind Voroperationen an der Prostata wie TURP oder Adenomektomie.
Falsch-positiver PSA-Test:
Die PSA-Konzentration liegt über dem Normbereich, aber es liegt kein Prostatakarzinom vor. Die wichtigsten Ursachen sind die benigne Prostatahyperplasie, Entzündung (Prostatitis), Harnverhalt, Traumata, sexuelle Aktivität und exzessives Radfahren (Tchetgen u.a., 1996). Nach iatrogenen Manipulationen wie Zystoskopie oder Katheterisierung ist eine PSA-Erhöhung möglich (Oesterling u.a., 1993b). Eine rektale Untersuchung führt nur zu einer geringen PSA-Erhöhung (im Mittel um 0,4 ng/ml) und ist selten die Ursache für falsch-pathologische Werte (Chybowski u.a., 1992) (Crawford u.a., 1992). Nach einer Prostatabiopsie dauert die Normalisierung des PSA-Wertes bis zu vier Wochen (Oesterling u.a., 1993b).
Verbesserung der Sensitivität und Spezifität bei Vorsorgeuntersuchungen:
Die oben genannten Zahlen verdeutlichen die geringe PSA-Sensitivität und Spezifität. Eine Verbesserung kann durch altersabhängige Grenzwerte, die Berücksichtigung der freien PSA-Konzentration (fPSA), der PSA-Dichte, der PSA-Velocity und einen längeren Messwertverlauf erreicht werden.
Altersabhängige PSA-Grenzwerte:
Altersabhängige PSA-Grenzwerte können bei älteren Patienten unnötige Stanzbiopsien vermeiden und bei jüngeren Patienten potentiell aggressive Tumoren zusätzlich entdecken (Oesterling et al., 1993a), sind aber umstritten (Littrup et al., 1994).
- <50 Lebensjahre: <2,5 ng/ml
- 50–59 Lebensjahre: < 3,5 ng/ml
- 60–69 Lebensjahre: < 4,5 ng/ml
- 70–79 Lebensjahre: < 6,5 ng/ml
Freies prostataspezifisches Antigen (fPSA):
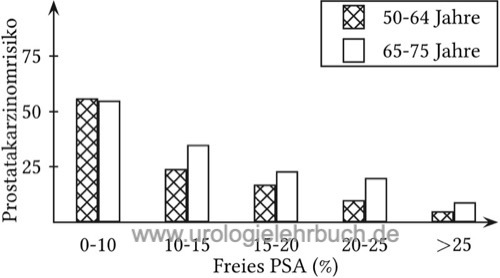
Mit abnehmenden Anteil des fPSA erhöht sich die Wahrscheinlichkeit für ein Prostatakarzinom. Das fPSA wird verwendet, um die Sensitivität des PSA bei Vorsorgeuntersuchungen im Bereich von 2–4 ng/ml zu erhöhen. Weiterhin kann mit dem fPSA die Spezifität des PSA im Bereich von 4–10 ng/ml verbessert werden. Ein fPSA-Anteil von über 20–25 % gilt als unverdächtig für ein Prostatakarzinom. Zahlreiche Studien konnten einen Zusammenhang zwischen einem niedrigen fPSA-Anteil und einem aggressiven Prostatakarzinom vor kurativer Therapie nachweisen (Masieri u.a., 2012).
 |
Das fPSA besteht aus verschiedenen Isoformen, das falsch gespaltene und damit inaktive proPSA (genauer: Isoform [-2]proPSA) konnte in manchen Studien bessere Vorhersagewerte als tPSA oder fPSA erreichen (Lazzeri u.a., 2013) (Furuya u.a., 2017). Die klinische Anwendung ist jedoch noch nicht etabliert.
Komplexiertes PSA (cPSA):
Spezielle Messmethoden können auch das an Makromoleküle im Blut gebundene cPSA erfassen. Im Umkehrschluss zum freien PSA (fPSA) ist das cPSA bei einem Prostatakarzinom erhöht. Die Bestimmung des cPSA hat sich im klinischen Alltag nicht durchgesetzt, ein deutlicher Vorteil gegenüber der fPSA-Bestimmung ist bisher nicht erbracht worden.
PSA-Dichte (PSAD):
Bei Patienten mit vergrößerter Prostata (BPH) und PSA-Werten über 4 ng/ml kann die Beachtung der PSA-Dichte unnötige Prostatabiopsien vermeiden. Die PSA-Dichte errechnet sich nach folgender Formel:
PSADichte = PSA [ng/ml] / Prostatavolumen [ml]
Ab einer PSADichte über 0,1–0,15 ist die Wahrscheinlichkeit eines Prostatakarzinoms erhöht.
PSA-Anstiegsgeschwindigkeit oder PSA-Velocity:
Mit Hilfe von drei PSA-Bestimmungen (PSA1–3) innerhalb von 2 Zeitabschnitten (t1–2) kann die PSA-Velocity nach Formel 1.2 ausgerechnet werden. Je länger die Messreihe, desto aussagekräftiger ist die PSA-Velocity. Der Anstieg von mehr als 0,75 ng/ml/Jahr weist auf ein Prostatakarzinom hin (Carter u.a., 1992):
 |
Die Beachtung der PSA-Velocity erhöht die Sensitivität und Spezifität der PSA-Messung.
PSA-Verdoppelungszeit (PSADT):
Die PSA-Verdoppelungszeit ist ein guter Parameter, um die Prognose eines PSA-Anstieges nach kurativer Therapie zu beurteilen. Eine Verdopplungszeit von weniger als 6–12 Monaten spricht für eine schlechte Prognose (Metastasen, Tod durch Prostatakarzinom). Die Berechung der PSA-Verdoppelungszeit ist komplex. Genaue Berechnungen können nur mit mehreren PSA-Werten über maximal 12 Monate erreicht werden, mehrere Formeln existieren in der Literatur (Arlen, 2008).
Als Näherung kann die folgende Formel verwendet werden, benötigt werden 2 PSA-Werte (PSA1 und PSA2) im Abstand eines Zeitintervalls von mindestens 3 Monaten. Die Formel verwendet ln, den natürlichen Logarithmus mit der Basis e. Das Zeitintervall sollte in Monaten angegeben werden, als Ergebnis errechnet die Formel die PSA-Verdoppelungszeit (PSADT) in Monaten:
 |
| Blutgerinnung | Suchen | Tumormarker AFP |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Babaian u.a. 1998 BABAIAN, R. J. ; FRITSCHE, H. A. ; ZHANG, Z. ; ZHANG, K. H. ; MADYASTHA, K. R. ; BARNHILL, S. D.: Evaluation of prostAsure index in the detection of prostate cancer: a preliminary report.In: Urology
51 (1998), Nr. 1, S. 132–6
Carter u.a. 1992 CARTER, H. B. ; PEARSON,
J. D. ; METTER, E. J. ; BRANT, L. J. ; CHAN,
D. W. ; ANDRES, R. ; FOZARD, J. L. ; WALSH, P. C.:
Longitudinal evaluation of prostate-specific antigen levels in men
with and without prostate disease.
In: Jama
267 (1992), Nr. 16, S. 2215–20
Catalona u.a. 1997 CATALONA, W. J. ; BEISER,
J. A. ; SMITH, D. S.:
Serum free prostate specific antigen and prostate specific antigen
density measurements for predicting cancer in men with prior negative
prostatic biopsies.
In: J Urol
158 (1997), Nr. 6, S. 2162–7
Catalona u.a. 1994 CATALONA, W. J. ; RICHIE,
J. P. ; DEKERNION, J. B. ; AHMANN, F. R. ;
RATLIFF, T. L. ; DALKIN, B. L. ; KAVOUSSI, L. R. ;
MACFARLANE, M. T. ; SOUTHWICK, P. C.:
Comparison of prostate specific antigen concentration versus prostate
specific antigen density in the early detection of prostate cancer: receiver
operating characteristic curves.
In: J Urol
152 (1994), Nr. 6 Pt 1, S. 2031–6
Chybowski u.a. 1992 CHYBOWSKI, F. M. ;
BERGSTRALH, E. J. ; OESTERLING, J. E.:
The effect of digital rectal examination on the serum prostate
specific antigen concentration: results of a randomized study.
In: J Urol
148 (1992), Nr. 1, S. 83–6
Crawford u.a. 1992 CRAWFORD, E. D. ; SCHUTZ,
M. J. ; CLEJAN, S. ; DRAGO, J. ; RESNICK, M. I. ;
CHODAK, G. W. ; GOMELLA, L. G. ; AUSTENFELD, M. ;
STONE, N. N. ; MILES, B. J. ; AL. et:
The effect of digital rectal examination on prostate-specific antigen
levels.
In: Jama
267 (1992), Nr. 16, S. 2227–8
Guess u.a. 1993 GUESS, H. A. ; HEYSE, J. F. ;
GORMLEY, G. J.:
The effect of finasteride on prostate-specific antigen in men with
benign prostatic hyperplasia.
In: Prostate
22 (1993), Nr. 1, S. 31–7
Littrup u.a. 1994 LITTRUP, P. J. ; KANE,
R. A. ; METTLIN, C. J. ; MURPHY, G. P. ; LEE, F. ;
TOI, A. ; BADALAMENT, R. ; BABAIAN, R.:
Cost-effective prostate cancer detection. Reduction of low-yield
biopsies. Investigators of the American Cancer Society National Prostate
Cancer Detection Project.
In: Cancer
74 (1994), Nr. 12, S. 3146–58
Oesterling u.a. 1993a OESTERLING, J. E. ;
JACOBSEN, S. J. ; CHUTE, C. G. ; GUESS, H. A. ;
GIRMAN, C. J. ; PANSER, L. A. ; LIEBER, M. M.:
Serum prostate-specific antigen in a community-based population of
healthy men. Establishment of age-specific reference ranges.
In: Jama
270 (1993), Nr. 7, S. 860–4
Oesterling u.a. 1993b OESTERLING, J. E. ;
RICE, D. C. ; GLENSKI, W. J. ; BERGSTRALH, E. J.:
Effect of cystoscopy, prostate biopsy, and transurethral resection of
prostate on serum prostate-specific antigen concentration.
In: Urology
42 (1993), Nr. 3, S. 276–82
Polascik u.a. 1999 POLASCIK, T. J. ;
OESTERLING, J. E. ; PARTIN, A. W.:
Prostate specific antigen: a decade of discovery-what we have
learned and where we are going.
In: J Urol
162 (1999), Nr. 2, S. 293–306
Roobol u.a. 2004 ROOBOL, M. J. ; KRANSE, R. ;
KONING, H. J. de ; SCHRODER, F. H.:
Prostate-specific antigen velocity at low prostate-specific antigen
levels as screening tool for prostate cancer: results of second screening
round of ERSPC (ROTTERDAM).
In: Urology
63 (2004), Nr. 2, S. 309–13; discussion 313–5
Stamey u.a. 1987 STAMEY, T. A. ; YANG, N. ;
HAY, A. R.:
Prostate-specific antigen as a serum marker for adenocarcinoma of the
prostate.
In: N Engl J Med
317 (1987), S. 909
Stephan u.a. 2000 STEPHAN, C. ; JUNG, K. ;
BRUX, B. ; LEIN, M. ; SINHA, P. ;
SCHNORR, D. ; LOENING, S. A.:
Elimination of serum complexed prostate-specific antigen after
radical retropubic prostatectomy.
In: Clin Chem Lab Med
38 (2000), Nr. 4, S. 309–11
Tchetgen u.a. 1996 TCHETGEN, M. B. ; SONG,
J. T. ; STRAWDERMAN, M. ; JACOBSEN, S. J. ;
OESTERLING, J. E.:
Ejaculation increases the serum prostate-specific antigen
concentration.
In: Urology
47 (1996), Nr. 4, S. 511–6
 English Version: Prostate-specific antigen (PSA) test
English Version: Prostate-specific antigen (PSA) test
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siche Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.