Sie sind hier: Startseite > Prostata > Prostatakarzinom > Klinik
Prostatakarzinom: Früherkennung mit PSA und MRT
- Prostatakarzinom: Definition, Epidemiologie und Ursachen
- Prostatakarzinom: Pathologie
- Prostatakarzinom: Klinik, Vorsorgeuntersuchung, PSA
- Prostatakarzinom: Diagnose, Bildgebung, Staging
- Prostatakarzinom: Therapieübersicht, aktive Überwachung
- Prostatakarzinom: Operation
- Prostatakarzinom: Therapie (Strahlentherapie)
- Prostatakarzinom: Therapie (Brachytherapie, Kryotherapie, HIFU)
- Prostatakarzinom: kastrationssensibles Prostatakarzinom
- Prostatakarzinom: kastrationsresistentes Prostatakarzinom, Prävention
Klinik (Symptome) des Prostatakarzinoms
Das Prostatakarzinom verursacht im Frühstadium keine Symptome. In den allermeisten Fällen entsteht der Verdacht auf ein Prostatakarzinom durch eine auffällige rektale Untersuchung und/oder einen erhöhten PSA-Wert im Rahmen der Früherkennung. Im späteren Verlauf entsteht bei fortgeschrittenem Tumor:
- Harnverhalt (Volumenzunahme der Prostata)
- Hämaturie (Tumorzerfall, Neovaskularisierung)
- Knochenschmerz (Knochenmetastasen)
- Inkontinenz (Infiltration des Schließmuskels)
- Impotenz (Infiltration des N. cavernosus)
- Kompressionssymptome des Rückenmarks (Knochenmetastasen der Wirbelsäule)
- Blutungsneigung (Hyperfibrinolyse oder DIC)
- Flankenschmerzen oder Niereninsuffizienz (Harnstauungsnieren bei retroperitonealen Metastasen oder subtrigonaler Ureterinfiltration).
Früherkennung des Prostatakarzinoms (Krebsvorsorge)
Richtlinien für die Prostatakarzinom-Früherkennung
Die Früherkennungsuntersuchung besteht aus einem PSA-Test und der digital-rektalen Tastuntersuchung. Bei einem pathologischen Tastbefund und/oder anhaltend suspekten PSA-Werten werden weitere Untersuchungen veranlasst. Der Anteil von nachgewiesenen Prostatakarzinomen ist signifikant höher in Screeninggruppen verglichen mit Beobachtungsgruppen. Durch das Screening werden aber auch zahlreiche Karzinome entdeckt, die keiner Behandlung bedürfen. Eine Senkung der prostatakarzinomspezifischen Mortalität konnte in Screeningstudien nachgewiesen werden, ein Einfluss auf die Gesamtüberlebenszeit wurde (bisher) nicht nachgewiesen. Die Bedeutung der Früherkenung und unter welchen Bedingungen die Früherkennung für Männer angeboten werden soll ist unter Fachgesellschaften umstritten. Vor der Früherkennungsuntersuchung sollten Männer ergebnisoffen über die Vor- und Nachteile beraten werden, insbesondere über die Aussagekraft von positiven und negativen Testergebnissen, Überdiagnosen sowie über gegebenenfalls erforderliche weitere Maßnahmen [S3-Leitlinie Prostatakarzinom].
Zeitpunkt des PSA-Screening:
Die allgemeine Empfehlung für den Beginn von Früherkennungsuntersuchungen ist das 45. Lebensjahr [siehe Abbildung Flussdiagramm der Prostatakarzinom-Früherkennung mit PSA]. Bei Patienten mit hohem Risiko für ein PCA (Schwarze, erstgradige Verwandte mit Prostatakarzinom, familiäre Häufung) sollten die Früherkennung mit dem 40. Lebensjahr beginnen. Die Früherkennungsuntersuchung sollte jährlich durchgeführt werden. Bei niedrigem PSA (unter 2 ng/ml) und unauffälliger DRU können die Früherkennungsintervalle je nach PSA-Wert verlängert werden: : 1–2ng/ml alle 2 Jahre und unter 1 ng/ml alle 4 Jahre. Für Männer über 70 Jahre und einem PSA-Wert <1 ng/ml wird eine weitere PSA-gestützte Früherkennung nicht empfohlen.
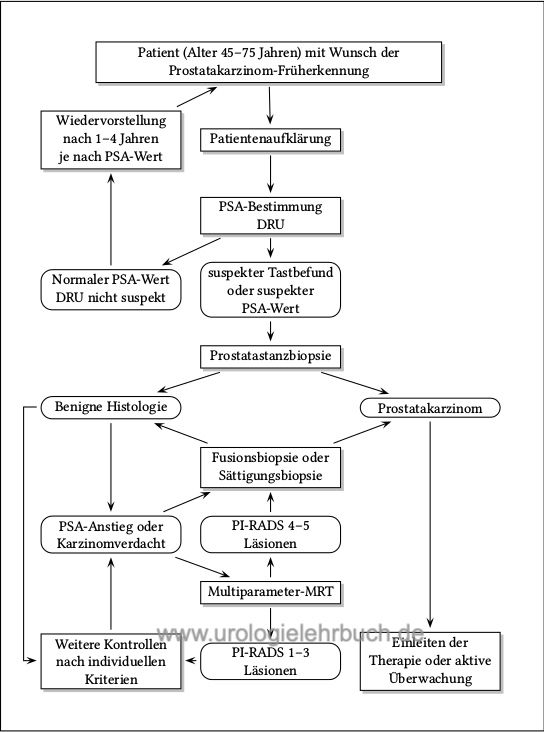 |
Evidenz der Früherkennung
Bisher gibt es zwei randomisierte Studien, welche die Reduktion der Mortalität durch die Früherkennung mit DRU und PSA untersucht haben.
PLCO-Studie:
Randomisierte Studie, 76 693 Männer, Screening mit DRU und PSA vs. "standard care" (Andriole et al., 2009). Anzahl der diagnostizierten Prostatakarzinome: 2820 vs. 2322. 50 vs. 44 Todesfälle (nicht signifikant). In der Nachbeobachtungszeit von 7 Jahren konnte keine signifikante Reduktion der Todesfälle durch ein Prostatakarzinom durch die Früherkennung mit Hilfe des PSA nachgewiesen werden. In einer Subgruppenanalyse (Männer mit geringer Komorbidität) konnte jedoch nach 10 Jahren ein Vorteil des PSA-Screenings nachgewiesen werden (Crawford u.a., 2011). Die Studie ist aufgrund von methodischen Fehlern in der Kritik, da in der Beobachtungsgruppe auch 90% der Patienten einen PSA-Test erhielten (Shoag u.a., NEJM 2016).
ERSPC-Studie:
Randomisierte Studie, 72 952 Männer erhielten Screening mit DRU und PSA vs. 89 435 Männer mit "standard care" (Schröder et al., 2009). Kumulative Inzidenz eines Prostatakarzinoms betrug in 9 Jahren Nachbeobachtungszeit 8,2 % vs. 4,8 %, in absoluten Zahlen 5990 vs. 4307. Relatives Risiko für einen Tod aufgrund eines Prostatakarzinoms in der Screening-Gruppe beträgt 0,8 (214 vs. 326 Todesfälle aufgrund eines Prostatakarzinoms). Werden Männer mit Non-Compliance ausgeschlossen, beträgt das relative Risiko für den Tod durch Prostatakrebs in der Screening-Gruppe 0,7, was einer Risikoreduktion von 30% entspricht (Roobol u.a., 2009). Das relative Risiko für Knochenmetastasen oder PSA über 100 ng/ml betrug in der Screening-Gruppe 0,59, Risikoreduktion um 41 %.
Nach den primären Ergebnissen der ERSPC-Studie (Nachbeobachtung 9 Jahre) müssen 1410 Männer am Früherkennungsprogramm teilnehmen (number needed to screen), um einen Todesfall aufgrund eines Prostatakarzinoms zu verhindern. Weiterhin müssen 48 Männer aufgrund eines Prostatakarzinoms behandelt werden (number needed to treat), um einen Todesfall aufgrund eines Prostatakarzinoms zu verhindern. Mit verlängerter Nachbeobachtung sinkt die Number needed to screen and to treat:
| Nachbeobachtung in Jahren | Number needed to screen | Number needed to treat |
| 9 | 1410 | 48 |
| 11 | 979 | 35 |
| 13 | 781 | 27 |
Argumente gegen die Früherkennungsuntersuchung mit PSA:
Gegner der regelmäßigen Früherkennung mit PSA-Bestimmung befürchten eine Übertherapie klinisch nicht signifikanter Prostatakarzinome und verweisen auf die Epidemiologie des Prostatakarzinoms und oben genannte Studien. Obwohl die ERSPC-Studie eine Senkung der Mortalität durch Früherkennung um bis zu 30% nachweisen konnte, erscheint Kritikern die Senkung als zu gering, um generell die Früherkennung mit PSA und DRU zu empfehlen.
Risikoadaptierte Früherkennungsuntersuchung:
Um eine Überdiagnose und Übertherapie zu vermeiden, wurde aufgrund der ERSPC-Daten ein Risikokalkulator entwickelt, welcher mit Hilfe verschiedender Faktoren (u.a. Alter, LUTS, Ethnizität, Familienanamnese, DRU, Prostatavolumen, PSA) das Risiko für eine karzinompositive Stanzbiopsie vorhersagen kann.
Diagnostik des Prostatakarzinoms
Digital-rektale Untersuchung (DRU)
Früherkennung:
Die Sensitivität der rektalen Untersuchung für das lokalisierte Prostatakarzinom ist sehr gering und daher als alleinige Früherkennungsdiagnostik ungeeignet. Auch die Spezifität der DRU ist gering (Wahrscheinlichkeit eines Prostatakarzinoms bei suspekter DRU), sie ist abhängig von der PSA-Konzentration: 5 % (0–1 ng/ml), 14 % (1,1 bis 2,5 ng/ml) und 29 % (2,6 bis 4 ng/ml) bei Männern ohne erhöhtes Risikoprofil.
Präoperative Einschätzung des lokalen Tumorstadiums:
T1 (nicht tastbar), T2 (tastbar, organbegrenzt), T3a (Organkapseldurchbruch), T3b (Samenblaseninvasion), T4 (Infiltration von Nachbarorganen wie Rektum oder Beckenwand). Die Genauigkeit der DRU für das lokale Tumorstadium ist gering. Bei lokal fortgeschrittenen Prostatakarzinomen wird eine Bildgebung der Beckenorgane empfohlen.
Prostataspezifisches Antigen (PSA)
Die PSA-Konzentration ist wichtig für die Früherkennung, als Prognoseparameter bei nachgewiesenem PCA vor Therapie und als Verlaufsparameter nach kurativer Therapie oder im metastasierten Stadium. Siehe Kapitel Laborwerte/PSA.
PSA und Vorsorge (Screening) des Prostatakarzinoms:
1g BPH-Gewebe erhöht das PSA um 0,3 ng/ml, während 1g Prostatakarzinomgewebe zur durchschnittlichen Erhöhung des PSA-Wertes um 3,5 ng/ml führt. Aufgrund der erheblichen Mengenunterschiede an Gewebe bei BPH (viele g) und Prostatakarzinom (wenige g) sind Normalwerte nicht in der Lage, zwischen einem PCA oder einer BPH zu differenzieren.
PSA-Grenzwerte:
Früher wurde ein starrer PSA-Grenzwert von 4 ng/ml verwendet, um eine Prostatabiopsie zu indizieren. Ein starrer Grenzwert führte jedoch zu einer schlechten Vorhersagegenauigkeit des PSA, die Folge waren zu viele umsonst durchgeführte Prostatastanzbiopsien und übersehene Prostatakarzinome.
Die Vorhersagegenauigkeit des PSA kann durch die kombinierte Betrachtung von altersabhängigen Grenzwerten, Anstiegsgeschwindigkeit (PSA-Velocity) und das freie PSA (fPSA) verbessert werden. Suspekt sind PSA-Werte über 2,5 ng/ml, eine PSA-Velocity über 0,75 ng/ml/Jahr und fPSA-Werte unter 20 % [Heidenreich (Eur Urol 2008)]. Ein erhöhter PSA-Wert soll unter Berücksichtigung von Störfaktoren kontrolliert werden. Ausführliche Darstellung des Tumormarkers PSA.
Zusätzlich muss die PSA-Konzentration in Abhängigkeit von weiteren klinischen Variablen interpretiert werden (Tastuntersuchung, Alter, Familienanamnese, Bildgebung). So können unnötige Stanzbiopsien vermindert werden und die Detektion eines Prostatakarzinoms wird verbessert [Tabelle PSA Wert, rektale Untersuchung und Prostatakarzinomrisiko]. Auch im Normbereich der PSA-Konzentration besteht ein Risiko für ein Prostatakarzinom [Tabelle Normale PSA Werte und Prostatakarzinomrisiko].
| DRU | PSA (ng/ml) | Risiko für PCA |
| unauffällig | 0–4 | 4–9 % |
| unauffällig | >4 | 12–32 % |
| suspekt | 0–4 | 13–21 % |
| suspekt | >4 | 42–72 % |
| PSA (ng/ml) | Risiko für PCA | Risiko für Gleason ≥7 |
| <0,5 | 7 % | 0,8 % |
| 0,6–1,0 | 10 % | 1 % |
| 1,1–2,0 | 17 % | 2 % |
| 2,1–3,0 | 24 % | 5 % |
| 3,1–4,0 | 27 % | 7 % |
Transrektale Ultraschalluntersuchung (TRUS) der Prostata
Die transrektale Ultraschalluntersuchung erfolgt mit 4 bis 10 MHz Schallköpfe mit transversaler und sagittaler Bildgebung. Prostatakarzinomherde stellen sich als echoarme Bezirke dar, sind aber häufig nicht zu sehen (isoechogen) [Abb. TRUS bei fortgeschrittenem Prostatakarzinom]. Prostatakarzinome, welche im TRUS als echoarme Bezirke sichtbar sind, haben ein größeres Tumorvolumen, eine höhere Gleason-Summe und eine schlechtere Prognose als nicht sichtbare Karzinome (Amiel und Slawin, 2006). Die transrektale Sonographie ist jedoch nicht zuverlässig genug, um zum Screening des lokal begrenzten Prostatakarzinoms eingesetzt zu werden. Moderne Ultraschallverfahren wie die Elastographie oder HistoScanning wurden entwickelt, um die Sichtbarkeit des Prostatakarzinoms zu erhöhen, konnten sich in kontrollierten Studien jedoch nicht durchsetzen. Die Sensitivität und Spezifität der genannten Verfahren ist jedoch zu gering, um auf die systematische Prostatastanzbiopsie zu verzichten, siehe Abschnitt experimentelle Diagnostik des Prostatakarzinoms.
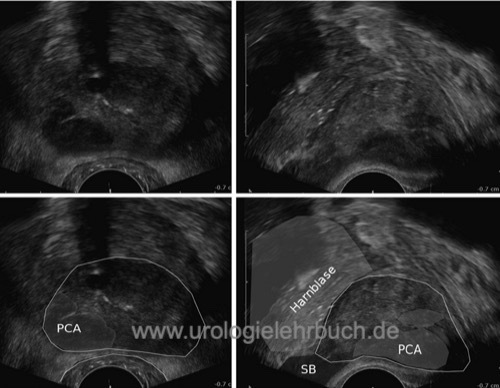 |
Multiparameter-MRT der Prostata
Das Multiparameter-MRT (mpMRT) ist ein neu eingeführtes Verfahren mit vielversprechenden klinischen Ergebnissen, es dient zur Lokalisation des intraprostatischen Tumorwachstums und zur Einschätzung des lokalen Tumorstadiums (Ahmed u.a., 2017).. Voraussetzung für die Durchführung eines mpMRT ist die Verwendung von Hochfeldgeräten von 1,5 oder 3 Tesla. Das mpMRT verwendet verschiedene Untersuchungssequenzen wie T1-Wichtung, T2-Wichtung, diffusionsgewichtete Bildgebung (DWI), 1H-MR-Spektroskopie und die dynamische kontrastmittelunterstützte MRT (dceMRI), siehe auch Tab. Untersuchungssequenzen eines Multiparameter-MRT der Prostata und Abb. mpMRT Prostatakarzinom.
| Abkürzung | Beschreibung | Beurteilung |
| T1 | Zeitkonstante der Längsrelaxation | Die physiologische Signalintensität der Prostata in der T1-Wichtung ist intermediär bis niedrig. |
| T2 | Zeitkonstante der Querrelaxation | Die normale periphere Zone hat ein hohes homogenes Signal in der T2-Wichtung, die schmale Prostatakapsel zeigt eine niedrigere Intensität. Typischerweise stellen sich Karzinome mit einer Signalabsenkung dar. |
| DWI | Diffusion weighted imaging | Darstellung der Brown-Molekularbewegung des Wassers in den Zellzwischenräumen. Diese ist im Falle eines Prostatakarzinoms aufgrund der höheren Zelldichte vermindert. |
| 1H-MRS | Protonen-MR-Spektroskopie | Informationen über die relative Konzentration von Zellmetaboliten wie Cholin (Membranstruktur), Citrat (Energielieferant), Kreatin und Polyaminen, welche auch Aussagen über die Aggressivität des Prostatakarzinoms erlauben. |
| dceMRI | dynamische kontrastmittelunterstützte MRT | wiederholte T1-gewichtete Sequenzen nach Kontrastmittelgabe ermöglichen eine Aussage über die Quantität der Blutgefäße, das Blutvolumen, den Blutfluss sowie über die Kapillarpermeabilität. |
Indikationen:
Die Durchführung eines mpMRT vor einer Stanzbiopsie bietet mehrere Vorteile: suspekte Areale in der Bildgebung können gezielt biopsiert werden und Patienten mit komplett unauffälliger Bildgebung können zunächst weiter beobachtet werden (je nach PSA-Wert). In den aktuellen EAU-Leitlinie (Stand 2022) wird das mpMRT vor der ersten Stanzbiopsie empfohlen, die deutsche S3 Leitlinie ist zurückhaltender und spricht eine "kann" Empfehlung aus. Nach aktueller Datenlage liegt die Spezifität bei 85–90% zum Ausschluss eines signifikantem Prostatakarzinom. Bei hohem klinischem Verdacht und bei unauf"|fälliger Bildgebung sollte trotzdem eine Stanzbiopsie empfohlen werden.
Alle aktuellen Leitlinien empfehlen das mpMRT nach negativer Stanzbiopsie und anhaltendem Verdacht auf Prostatakarzinom. Bei unauffälliger Bildgebung kann auf eine weitere Stanzbiopsie zunächst verzichtet werden, bei suspekten Läsionen sind zielgerichtete Stanzbiopsien möglich.
Das fortgeschrittene Prostatakarzinom ist ebenfalls eine Indikation für ein mpMRT, dabei sollten zusätzlich die pelvinen Lymphknoten beurteilt werden.
Das mpMRT im Rahmen der aktiven Überwachung ist ein guter Verlaufsparameter. Die aktuellen Leitlinien empfehlen ein mpMRT zu Beginn der aktiven Überwachung und vor jeder weiteren Kontrollbiopsie.
PI-RADS-Klassifikation:
Um die Qualität von Durchführung und Befundung zu steigern und zu standardisieren, hat die European Society of Urogenital Radiology (ESUR) 2012 eine Leitlinie herausgegeben, welche im Jahr 2014 aktualisiert wurde [Tab. PI-RADS-Klassifikation zur Befundung von mpMRT]. PI-RADS steht für Prostate Imaging Reporting and Data System. Je höher der PI-RADS Score einer Läsion, desto wahrscheinlicher ist das Vorliegen eines signifikanten Prostatakarzinoms.
| PI-RADS Score | Wahrscheinlichkeit eines Prostatakarzinoms |
| 1 | sehr unwahrscheinlich |
| 2 | unwahrscheinlich |
| 3 | fragwürdig, unklarer Befund (15%) |
| 4 | wahrscheinlich (27%), Läsion <1,5 cm |
| 5 | sehr wahrscheinlich (88%), Läsion >1,5 cm |
Die Lokalisation der Läsionen in der Prostata wird ebenfalls standardisiert beschrieben: die Prostata wird entlang der Harnröhre in rechts und links eingeteilt, weiterhin wird die Prostata in anterior/posterior und Apex/Mitte/Basis gegliedert. Die Läsionen werden zusätzlich den einzelnen Zonen zugeordnet: periphere Zone, Transitionalzone, Zentralzone oder anteriores fibromuskuläres Stroma.
Prostatastanzbiopsie
Indikationen zur Prostatastanzbiopsie:
Die Indikation zur Prostatabiopsie begründet sich durch eine suspekte DRU und/oder durch einen erhöhten PSA-Wert. Die isolierte asymptomatische PSA-Erhöhung sollte durch mehrfache Bestimmungen kontrolliert werden. Im Zweifel kann ein Multiparameter-MRT der Prostata bei der Entscheidung für oder gegen eine Prostatabiopsie weiterhelfen, siehe oben. Diskussion der PSA-Grenzwerte siehe S. Kapitel Laborwerte/PSA. Ab einem gewissen Lebensalter hat das Prostatakarzinom keinen signifikanten Einfluss auf die Lebenserwartung, so ist die Prostatastanzbiopsie bei einer Lebenserwartung von deutlich unter 10 Jahren nur bei V. a. auf ein symptomatisches fortgeschrittenes Prostatakarzinom indiziert.
Negative Stanzbiopsie bei erhöhtem PSA-Wert:
Vor weiteren Stanzbiopsien sollte ein mpMRT der Prostata zur weiteren Planung vorliegen. Bei klinischem Verdacht auf ein Prostatakarzinom (PIRADS ≥3), sollte die Stanzbiopsie (als Fusionsbiopsie) wiederholt werden. Zeigen sich in der Bildgebung keine suspekten Areale (PIRADS ≤2), kann je nach klinischem Risiko auf eine zweite Stanzbiopsie verzichtet werden oder es wird erneut eine systematische Prostatabiopsie durchgeführt. Die Folgebiopsie kann ohne Sorgen bezüglich eines Tumorprogresses mindestens 6 Monate verzögert stattfinden. Die Ergebnisse der Europäischen Screening-Studie zeigen, dass v.a. kleine Tumoren durch die erste Biopsie nicht getroffen werden.
Technik der Prostatastanzbiopsie:
Veralteter Standard ist die transrektale ultraschall-gesteuerte Prostatastanzbiopsie mit mindestens 10 Stanzzylindern, welche aus der peripheren Zone der Prostata entnommen werden sollen. Zur Vermeidung von Infektionen sollte die Prostatastanzbiopsie über einen perinealen Zugangsweg angeboten werden. Bei Vorliegen eines mpMRT der Prostata ist die Fusionsbiopsie der Prostata möglich, siehe Kapitel Prostatastanzbiopsie zur Technik.
Pathologische Interpretation der Prostatastanzbiopsie:
Siehe Abschnitt Prostatakarzinom/Pathologie zur Interpretation des histologischen Ergebnisses.
| Prostatakarzinom: Pathologie | Suchen | Staging des Prostatakarzinoms |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Ahmed, H. U.; El-Shater Bosaily, A.; Brown, L. C.; Gabe, R.; Kaplan, R.; Parmar, M. K.; Collaco-Moraes, Y.; Ward, K.; Hindley, R. G.; Freeman, A.; Kirkham, A. P.; Oldroyd, R.; Parker, C.; Emberton, M. & study group , P. Diagnostic accuracy of multi-parametric MRI and TRUS biopsy in prostate cancer (PROMIS): a paired validating confirmatory study.Lancet (London, England), 2017, 389, 815-822.
Amiel und Slawin 2006 AMIEL, Gilad E. ; SLAWIN, Kevin M.: Newer modalities of ultrasound imaging and treatment of the prostate.
In: Urol Clin North Am
33 (2006), Aug, Nr. 3, S. 329–337.
G. L. Andriole, R. L. Grubb, S. S. B. et. al., and the PLCO Project Team. Mortality results from a randomized prostate-cancer screening trial.
N Engl J Med, Mar 2009. Cooner u.a. 1990 COONER, W. H. ; MOSLEY, B. R. ; RUTHERFORD, Jr. ; BEARD, J. H. ; POND, H. S. ; TERRY, W. J. ; IGEL, T. C. ; KIDD, D. D.: Prostate cancer detection in a clinical urological practice by ultrasonography, digital rectal examination and prostate specific antigen.
In: J Urol
143 (1990), Nr. 6, S. 1146–52; discussion 1152–4
Crawford, E. D.; Grubb, 3rd, R.; Black, A.; Andriole, Jr, G. L.; Chen, M.-H.; Izmirlian, G.; Berg, C. D. & D'Amico, A. V. Comorbidity and mortality results from a randomized prostate cancer screening trial.
J. Clin. Oncol. 2011, 29, 355-361.
DeMarzo u.a. 2003 DEMARZO, A. M. ; NELSON,
W. G. ; ISAACS, W. B. ; EPSTEIN, J. I.:
Pathological and molecular aspects of prostate cancer.
In: Lancet
361 (2003), Nr. 9361, S. 955–64
Leitlinienprogramm Onkologie (DGU, Deutsche Krebsgesellschaft, Deutsche Krebshilfe):
Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms https://www.leitlinienprogramm-onkologie.de/leitlinien/prostatakarzinom/
Ellis u.a. 1994 ELLIS, W. J. ; CHETNER,
M. P. ; PRESTON, S. D. ; BRAWER, M. K.:
Diagnosis of prostatic carcinoma: the yield of serum prostate
specific antigen, digital rectal examination and transrectal ultrasonography.
In: J Urol
152 (1994), Nr. 5 Pt 1, S. 1520–5
Epstein u.a. 1993 EPSTEIN, J. I. ; PIZOV, G. ;
WALSH, P. C.:
Correlation of pathologic findings with progression after radical
retropubic prostatectomy.
In: Cancer
71 (1993), Nr. 11, S. 3582–93
EAU Guidelines
EAU - EANM - ESTRO - ESUR - SIOG Guidelines on
Prostate Cancer, https://uroweb.org/guidelines/prostate-cancer/.
Hammerer und Huland 1994 HAMMERER, P. ; HULAND,
H.:
Systematic sextant biopsies in 651 patients referred for prostate
evaluation.
In: J Urol
151 (1994), Nr. 1, S. 99–102
Partin u.a. 1997 PARTIN, A. W. ; KATTAN,
M. W. ; SUBONG, E. N. ; WALSH, P. C. ; WOJNO,
K. J. ; OESTERLING, J. E. ; SCARDINO, P. T. ;
PEARSON, J. D.:
Combination of prostate-specific antigen, clinical stage, and Gleason
score to predict pathological stage of localized prostate cancer. A
multi-institutional update.
In: Jama
277 (1997), Nr. 18, S. 1445–51
Pound u.a. 1999 POUND, C. R. ; PARTIN, A. W. ;
EISENBERGER, M. A. ; CHAN, D. W. ; PEARSON,
J. D. ; WALSH, P. C.:
Natural history of progression after PSA elevation following radical
prostatectomy.
In: Jama
281 (1999), Nr. 17, S. 1591–7
Roobol, M. J.; Kerkhof, M.; Schröder, F. H.; u.a.m.
Prostate cancer mortality reduction by
prostate-specific antigen-based screening adjusted for nonattendance and
contamination in the European Randomised Study of Screening for Prostate
Cancer (ERSPC).
Eur. Urol. 2009, 56, 584-591.
Leitlinienprogramm Onkologie (DGU, Deutsche Krebsgesellschaft, Deutsche Krebshilfe):
Interdisziplinäre Leitlinie der Qualität S3 zur Früherkennung, Diagnose und Therapie der verschiedenen Stadien des Prostatakarzinoms https://www.leitlinienprogramm-onkologie.de/leitlinien/prostatakarzinom/ (Zugriff am: 2.2.2018)
Wein, A. J.; Kavoussi, L. R.; Partin, A. P. & Peters, C. A.
Campbell-Walsh Urology
. Elsevier, 2015. ISBN 978-1455775675.
F. H. Schröder, J. Hugosson, M. J. R. et. al., and the ERSPC Investigators.
Screening and prostate-cancer mortality in a randomized european
study.
N Engl J Med, Mar 2009.
Schröder, F. H.; Hugosson, J.; Roobol, M. J.; Tammela,
T. L. J.; Zappa, M.; Nelen, V.; Kwiatkowski, M.; Lujan, M.; Määttänen, L.;
Lilja, H.; Denis, L. J.; Recker, F.; Paez, A.; Bangma, C. H.; Carlsson,
S.; Puliti, D.; Villers, A.; Rebillard, X.; Hakama, M.; Stenman, U.-H.;
Kujala, P.; Taari, K.; Aus, G.; Huber, A.; van der Kwast, T. H.; van
Schaik, R. H. N.; de Koning, H. J.; Moss, S. M.; Auvinen, A. & , E. R. S.
P. C. I.
Screening and prostate cancer mortality: results of the
European Randomised Study of Screening for Prostate Cancer (ERSPC) at 13
years of follow-up.
Lancet, 2014, 384, 2027-2035.
Thompson u.a. 2004 THOMPSON, I. M. ; PAULER,
D. K. ; GOODMAN, P. J. ; TANGEN, C. M. ; LUCIA,
M. S. ; PARNES, H. L. ; MINASIAN, L. M. ; FORD,
L. G. ; LIPPMAN, S. M. ; CRAWFORD, E. D. ;
CROWLEY, J. J. ; COLTMAN, Jr.:
Prevalence of prostate cancer among men with a prostate-specific
antigen level < or =4.0 ng per milliliter.
In: N Engl J Med
350 (2004), Nr. 22, S. 2239–46
A. W. Partin, C. A. Peters, L. R. Kavoussi, R. R. Dmochowski, and A. J. Wein, Campbell-Walsh-Wein Urology, 12th ed. ISBN-13: 978-1455775675: Elsevier, 2020.
 English Version: Screening of prostate carcinoma
English Version: Screening of prostate carcinoma
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.