Sie sind hier: Startseite > Medikamente > Androgendeprivationstherapie > Grundlagen
Medikamentöse Androgendeprivationstherapie: Substanzen und Nebenwirkungen
- Androgendeprivationstherapie: Chemische Einteilung, Nebenwirkungen
- Flutamid
- Bicalutamid
- GnRH-Agonisten Leuprorelin und Goserelin
- GnRH-Antagonisten Degarelix und Relugolix
- Abirateron
- Enzalutamid
- Apalutamid
- Darolutamid
Indikationen zur Androgendeprivationstherapie
Die Androgendeprivationstherapie (ADT) ist indiziert bei einem fortgeschrittenem Prostatakarzinoms in den folgenden Situationen, siehe auch Kapitel [Therapie des metastasierten Prostatakarzinoms]:
- metastasiertes Prostatakarzinom
- biochemischer Progress eines Prostatakarzinoms ohne nachweisbare Metastasen mit einer PSA-Verdopplungszeit unter 3 Monaten
- adjuvante Therapie des fortgeschrittenen Prostatakarzinoms nach RPE oder EBRT
- konservative Therapie eines lokal fortgeschrittenen Prostatakarzinoms mit LUTS
- Senkung des Prostatavolumens vor Seeds-Therapie
Substanzklassen zur medikamentösen Androgendeprivation
Androgenrezeptorblocker:
Nichtsteroidale Medikamente sind Bicalutamid und Flutamid. Cyproteronacetat ist ein Steroidhormon mit antagonistischen Eigenschaften am Androgenrezeptor und einer gestagenen Wirkkomponente, welche eine zusätzliche zentrale Hemmung der Testosteronkonzentration vermittelt.
GnRH-Analoga:
Buserelin, Goserelin, Histrelin, Leuprorelin, Triptorelin.
GnRH-Antagonisten:
Östrogene:
Fosfestrol
Hemmer der Testosteronbiosynthese:
Moderne Androgenrezeptorblocker:
Enzalutamid, Apalutamid, Darolutamid.
Grundzüge der Androgendeprivationstherapie
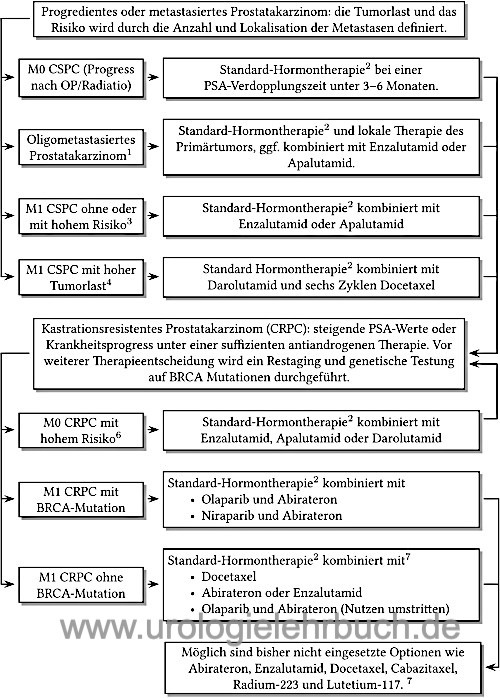
Die einzelnen Therapieoptionen werden in Abhängigkeit des Krankheitsprogress und Ansprechen sequenziell oder kombiniert angewendet [Abb. Hormontherapie]. (Albers u.a., 2020).
Allgemeine Nebenwirkungen der Androgendeprivation
Die Androgendeprivationstherapie zeigt insbesondere bei langfristiger Anwendung erhebliche Nebenwirkungen. Androgenrezeptorblocker senken nicht die Testosteronkonzentration und verursachen weniger Nebenwirkungen (Ausnahme Gynäkomastie) als Orchiektomie oder GnRH Agonisten und Antagonisten. Allgemeine Maßnahmen zur Prophylaxe unten aufgeführter Nebenwirkungen sind die Steigerung der körperliche Aktivität, Anstreben eines normalen Körpergewichts, vitaminreiche gesunde Ernährung und Nichtrauchen.
Hitzewallungen und Schwitzen:
Häufige Nebenwirkung, diese sollte nur bei starker Manifestation behandelt werden. Therapieoptionen sind (off-label Anwendung) Clonidin (1 mg/d), Cyproteronacetat, Venlafaxin oder Paroxetin (Loprinzi u.a., 2004).
Verminderte Erektionsfähigkeit und Libido:
Die ADT führt zur einer ausgeprägten erektilen Dysfunktion (über 80%) und Libidoverlust (über 95%). Eine effektive Therapie des Libidoverlustes ist nicht möglich, der Leidensdruck hinsichtlich der sexuellen Funktionsstörung ist jedoch gering. Therapeutischen Optionen gegen die erektile Dysfunktion (PDE5-Hemmer oder SKAT) werden selten gewünscht. Eine langfristige ADT führt zu einer Verringerung sowohl der Penislänge als auch der Hodengröße.
Gynäkomastie:
Die Gynäkomastie ist eine sehr häufige Nebenwirkung bei Androgenrezeptorantagonisten. Bei alleiniger Gabe von 150 mg Bicalutamid beträgt das Gynäkomastierisiko deutlich über 70% nach einem Jahr. Die prophylaktische einmalige Bestrahlung der Brustdrüsen vor Therapiebeginn mit 12–18 Gy senkt deutlich das Risiko (auf 30 bis 50%) (Widmark u.a., 2003) (Tyrrell u.a., 2004) Das Risiko der Gynäkomastie für eine kombinierte Androgendeprivationstherapie ist geringer und beträgt etwa 20%, bei der alleinigen Anwendung von GnRH Agonisten und Antagonisten ist die Gynäkomastie selten.
Die prophylaktische Gabe von Tamoxifen ist potenter als die Bestrahlung um die Häufigkeit der Gynäkomastie zu reduzieren (10 % vs. 30–50%). Die Dosierung von Tamoxifen beträgt 20 mg/d. Die Wirkung von Tamoxifen scheint nicht die Androgendeprivationstherapie und das biologische Verhalten des Prostatakarzinoms zu beeinflussen (Fradet u.a., 2007). Eine weitere Therapieoption ist die subkutane Mastektomie.
Psychische Störungen:
Die Gedächtnisfunktion wird durch die Androgendeprivationstherapie gestört. Weiterhin sind eine verminderte Libido, körperliche Schwäche, Müdigkeit und Depressionen (RR 8) gehäuft.
Metabolische Veränderungen:
Die Androgendeprivation führt zur einem Verlust an Muskelmasse und Zunahme des Körperfetts, nach einem Jahr hat das Körpergewicht durchschnittlich 2–4% zugenommen. Das Risiko für ein metabolisches Syndrom und für Typ II Diabetes wird ebenfalls deutlich erhöht (Yu u.a., 2014).
Osteoporose und Frakturen:
Die Osteoporose ist eine häufige Komplikation der langfristigen Androgendeprivationstherapie durch Kastration, GnRH-Analoga oder GnRH-Antagonisten (Diamond u.a.,2004b). Das Frakturrisiko beträgt für Männer mit einer Überlebensrate von über 5 Jahren 19% mit ADT versus 13% ohne ADT. Die Gabe von Androgenrezeptorblockern (z.B. Bicalutamid) sind nicht mit einer Osteoporose assoziiert (Sieber ua.a, 2004) (SmithMR, 2004). Alle Patienten mit einer langfristigen Prognose sollten prophyaktisch Vitamin D (800–1000 IU) und Calcium (1000 mg) erhalten. Zusätzlich Therapieoptionen gegen die Osteoporose sind Bisphosphonate [Zoledronat] oder Denosumab.
Kardiovaskuläre Risiken:
Die antiandrogene Therapie führt zu einer Zunahme kardiovaskulärer Erkrankungen (in Klammern das relative Risiko): KHK (RR 1,2), Herzinfarkt (RR 1,1), lebensbedrohliche Herzrhythmusstörungen oder plötzlicher Herztod (RR 1,16). Die kardiovaskuläre Mortalität steigt im Vergleich zur Placebogruppe um 1–6%, je nach Studie und Nachbeobachtungszeit Levine u.a. (2010).Anämie:
Bei langfristiger ADT entsteht eine normochrome normozytäre Anämie, welche gut auf Erythropoetin anspricht Choo u.a. (2005).
| Schmerztherapie | suchen | Flutamid |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
Anderson 2003 ANDERSON, J.:
The role of antiandrogen monotherapy in the treatment of prostate
cancer.
In: BJU Int
91 (2003), Nr. 5, S. 455–61.
Choo u.a. 2005 CHOO, R. ; CHANDER, S. ;
DANJOUX, C. ; MORTON, G. ; PEARCE, A. ;
DEBOER, G. ; SZUMACHER, E. ; LOBLAW, A. ;
CHEUNG, P. ; WOO, T.:
How are hemoglobin levels affected by androgen deprivation in
non-metastatic prostate cancer patients?
In: Can J Urol
12 (2005), Nr. 1, S. 2547–52.
Diamond u.a. 2004 DIAMOND, T. H. ; HIGANO,
C. S. ; SMITH, M. R. ; GUISE, T. A. ; SINGER,
F. R.:
Osteoporosis in men with prostate carcinoma receiving
androgen-deprivation therapy: recommendations for diagnosis and therapies.
In: Cancer
100 (2004), Nr. 5, S. 892–9.
Fradet u.a. 2007 FRADET, Yves ; EGERDIE,
Blair ; ANDERSEN, Morten ; TAMMELA, Teuvo L J. ;
NACHABE, Mahmoud ; ARMSTRONG, Jon ; MORRIS,
Thomas ; NAVANI, Sunil:
Tamoxifen as prophylaxis for prevention of gynaecomastia and breast
pain associated with bicalutamide 150 mg monotherapy in patients with
prostate cancer: a randomised, placebo-controlled, dose-response study.
In: Eur Urol
52 (2007), Jul, Nr. 1, S. 106–114.
Levine, Glenn N; D'Amico, Anthony V; Berger, Peter;
Clark, Peter E; Eckel, Robert H; Keating, Nancy L; Milani, Richard V;
Sagalowsky, Arthur I; Smith, Matthew R; Zakai, Neil; on Clinical
Cardiology, American Heart Association Council; on Epidemiology, Council;
Prevention, the American Cancer Society & the American Urological
Association
Androgen-deprivation therapy in prostate cancer and cardiovascular risk: a science advisory from the American Heart Association, American Cancer Society, and American Urological Association:
endorsed by the American Society for Radiation Oncology.
CA Cancer J Clin, 2010, 60, 194-201
Loblaw u.a. 2004 LOBLAW, D. A. ; MENDELSON,
D. S. ; TALCOTT, J. A. ; VIRGO, K. S. ;
SOMERFIELD, M. R. ; BEN-JOSEF, E. ; MIDDLETON,
R. ; PORTERFIELD, H. ; SHARP, S. A. ; SMITH,
T. J. ; TAPLIN, M. E. ; VOGELZANG, N. J. ; WADE,
Jr. ; BENNETT, C. L. ; SCHER, H. I.:
American Society of Clinical Oncology recommendations for the initial
hormonal management of androgen-sensitive metastatic, recurrent, or
progressive prostate cancer.
In: J Clin Oncol
22 (2004), Nr. 14, S. 2927–41.
Loprinzi u.a. 2004 LOPRINZI, C. L. ; BARTON,
D. L. ; CARPENTER, L. A. ; SLOAN, J. A. ; NOVOTNY,
P. J. ; GETTMAN, M. T. ; CHRISTENSEN, B. J.:
Pilot evaluation of paroxetine for treating hot flashes in men.
In: Mayo Clin Proc
79 (2004), Nr. 10, S. 1247–51.
Montgomery u.a. 2005 MONTGOMERY, B. S. ;
BORWELL, J. P. ; HIGGINS, D. M.:
Does needle size matter? Patient experience of luteinising
hormone-releasing hormone analogue injection.
In: Prostate Cancer Prostatic Dis
8 (2005), Nr. 1, S. 66–8.
Miyamoto u.a. 2004 MIYAMOTO, H. ; MESSING,
E. M. ; CHANG, C.:
Androgen deprivation therapy for prostate cancer: current status and
future prospects.
In: Prostate
61 (2004), Nr. 4, S. 332–53.
Perdona u.a. 2005 PERDONA, S. ; AUTORINO, R. ;
DE PLACIDO, S. ; D’ARMIENTO, M. ; GALLO, A. ;
DAMIANO, R. ; PINGITORE, D. ; GALLO, L. ;
DE SIO, M. ; BIANCO, A. R. ; DI LORENZO, G.:
Efficacy of tamoxifen and radiotherapy for prevention and treatment
of gynaecomastia and breast pain caused by bicalutamide in prostate cancer: a
randomised controlled trial.
In: Lancet Oncol
6 (2005), Nr. 5, S. 295–300.
Sieber u.a. 2004 SIEBER, P. R. ; KEILLER,
D. L. ; KAHNOSKI, R. J. ; GALLO, J. ; MCFADDEN,
S.:
Bicalutamide 150 mg maintains bone mineral density during monotherapy
for localized or locally advanced prostate cancer.
In: J Urol
171 (2004), Nr. 6 Pt 1, S. 2272–6, quiz 2435
Smith u.a. 2003 SMITH, M. R. ; EASTHAM, J. ;
GLEASON, D. M. ; SHASHA, D. ; TCHEKMEDYIAN, S. ;
ZINNER, N.:
Randomized controlled trial of zoledronat to prevent bone loss
in men receiving androgen deprivation therapy for nonmetastatic prostate
cancer.
In: J Urol
169 (2003), Nr. 6, S. 2008–12.
Smith u.a. 2004a SMITH, M. R. ;
FALLON, M. A. ; LEE, H. ; FINKELSTEIN, J. S.:
Raloxifene to prevent gonadotropin-releasing hormone agonist-induced
bone loss in men with prostate cancer: a randomized controlled trial.
In: J Clin Endocrinol Metab
89 (2004), Nr. 8, S. 3841–6.
Smith u.a. 2004b SMITH, M. R. ;
GOODE, M. ; ZIETMAN, A. L. ; MCGOVERN, F. J. ;
LEE, H. ; FINKELSTEIN, J. S.:
Bicalutamide monotherapy versus leuprolide monotherapy for prostate
cancer: effects on bone mineral density and body composition.
In: J Clin Oncol
22 (2004), Nr. 13, S. 2546–53.
Tyrrell u.a. 2004 TYRRELL, C. J. ; PAYNE, H. ;
TAMMELA, T. L. ; BAKKE, A. ; LODDING, P. ;
GOEDHALS, L. ; VAN ERPS, P. ; BOON, T. ;
VAN DE BEEK, C. ; ANDERSSON, S. O. ; MORRIS, T. ;
CARROLL, K.:
Prophylactic breast irradiation with a single dose of electron beam
radiotherapy (10 Gy) significantly reduces the incidence of
bicalutamide-induced gynecomastia.
In: Int J Radiat Oncol Biol Phys
60 (2004), Nr. 2, S. 476–83.
Widmark u.a. 2003 WIDMARK, A. ; FOSSA, S. D. ;
LUNDMO, P. ; DAMBER, J. E. ; VAAGE, S. ;
DAMBER, L. ; WIKLUND, F. ; KLEPP, O.:
Does prophylactic breast irradiation prevent antiandrogen-induced
gynecomastia? Evaluation of 253 patients in the randomized Scandinavian trial
SPCG-7/SFUO-3.
In: Urology
61 (2003), Nr. 1, S. 145–51.
 English Version: androgen deprivation therapy
English Version: androgen deprivation therapy
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.