Sie sind hier: Startseite > Harnleiter > Harnleiterkarzinom > Therapie
Urothelkarzinom des oberen Harntrakts: Diagnose und Therapie
- Harnleiterkarzinom und Nierenbeckenkarzinom: Ursachen, Pathologie und Klinik
- Nierenbeckenkarzinom und Harnleiterkarzinom: Diagnose und Therapie
Diagnose des Urothelkarzinoms des oberen Harntrakts
Urinzytologie:
Die mikroskopische Untersuchung von abgeschilferten Urothelzellen im Urin oder in der Spülzytologie des oberen Harntrakts kann zuverlässig G2- und G3-Zellen eines Urothelkarzinoms identifizieren. Gut differenzierte Tumoren schilfern seltener Zellen ab und die Abgrenzung zu entzündlichen Veränderungen ist schwierig.
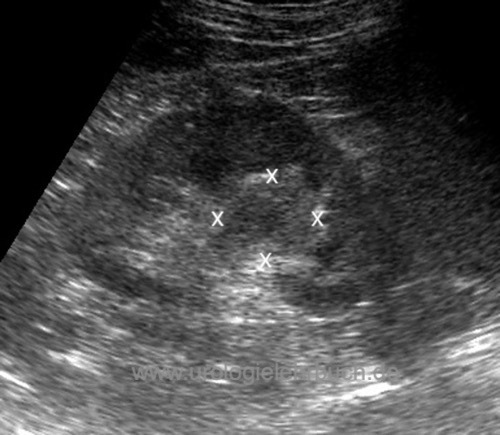
Sonographie:
Sonographie Abdomen zur Detektion von Harnstau, einer Raumforderung im Sinus renalis [Abb. Raumforderung im Sinus renalis] oder von Lebermetastasen.
 |
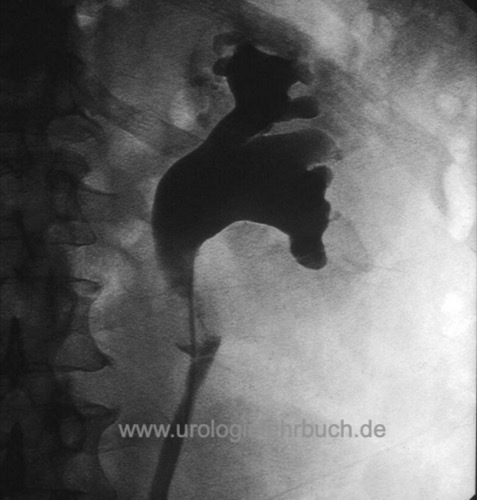
Retrograde Pyelographie:
Vor Kontrastmittelgabe wird eine Urinzytologie asserviert. Zeichen eines Urothelkarzinoms des oberen Harntrakts in der retrograden Pyelographie sind Ureterstrikturen, Füllungsdefekte oder fehlende Kontrastierung von Kelchgruppen [Abb. maligne Harnleiterstriktur].
 |
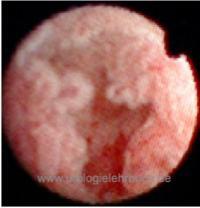
Ureterorenoskopie:
Starre und/oder flexible URS mit gezielten Biopsien [Abb. papilläres Nierenkelchkarzinom].
 |
Zystoskopie:
Bei Erstdiagnose von UTUC und im Verlauf, um ein Urothelkarzinom des unteren Harntrakts auszuschließen.
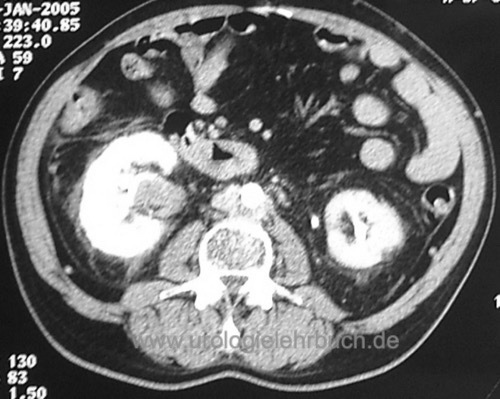
Staging des Urothelkarzinom des oberen Harntrakts:
CT-Abdomen [Abb. Nierenbeckenkarzinom und proximales Harnleiterkarzinom], CT-Thorax, bei Knochenschmerzen oder bei fortgeschrittenem Tumorstadium Knochenszintigraphie.
 |
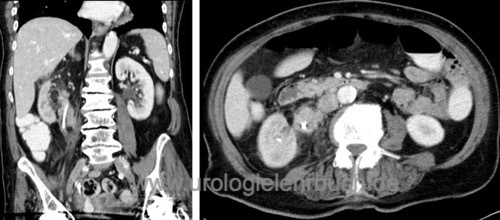 |
Urogramm:
Mittel der zweiten Wahl in der Bildgebung nach der Computertomographie, da das Urogramm das Staging nicht ersetzt. Zeichen des Harnleiterkarzinoms im Urogramm sind Füllungsdefekte, Harnstau oder Funktionsausfall der betroffenen Niere.
Risikostratifizierung des nicht-metastasierten UTUC
Die EAU-Leitlinien differenzieren zwischen einem low-risk und high-risk UTUC, um jene Patienten zu identifizieren, welche von einer weniger aggressiven Therapie mit Erhalt der Niere profitieren:
Niedriges Risiko:
Alle Faktoren müssen zutreffen: unifokaler Tumor unter 2 cm, low-grade Pathologie oder Zytologie, nicht-invasiver Tumor in der CT.
Hohes Risiko:
Besteht bei dem Vorliegen von einem Risikofaktor: Harnstau, Tumorgröße >2 cm, high-grade Pathologie oder Zytologie, multifokale Manifestation, Z.n. Zystektomie bei Harnblasenkarzinom, seltene Histologie.
Therapie des Niedrigrisiko-Urothelkarzinoms des oberen Harntrakts
Offene organerhaltende Verfahren:
Mittel der ersten Wahl bei Tumoren mit niedrigem Risiko. Bei höherem Risiko können organerhaltende Techniken zum Einsatz kommmen, wenn die Erhaltung der Nierenfunktion elementar für den Patienten ist. Problematisch sind die hohen Rezidivquoten bei high-grade Tumoren.
Distale Tumoren:
Distale Ureterektomie und Ureterozystoneostomie mit Psoas-Hitch- oder Boari-Flap-Technik.
Harnleitertumoren im mittleren Drittel:
Uretersegmentresektion und Ureteroureterostomie.
Proximale Harnleitertumoren und Nierenbeckentumoren:
Der Nierenerhalt ist technisch schwierig und wird selten durchgeführt: Pyelotomie und offene Tumorabtragung, Teilresektion des Nierenbeckens, Nierenteilresektion z.b. Oberpolresektion bei Tumoren des oberen Kelchsystems.
Multifokale Harnleitertumoren:
Ureterektomie mit Ileumersatz, selten angewandt in ausgewählten Fällen.
Endoskopische organerhaltende Verfahren:
Retrograder oder antegrader Zugang in das Hohlsystem. Der Tumor wird entweder mit einer Resektion oder durch Laserkoagulation entfernt (Chew u.a., 2005) (Ho und Chow, 2005).
Adjuvante Instillationstherapie des oberen Harntrakts:
Die Studienlage bezüglich einer adjuvanten Instillationstherapie mit BCG oder Mitomycin (über eine Nephrostomie oder MJ) ist uneinheitlich, die Wirksamkeit ist umstritten.
Postoperative intravesikale Chemotherapie:
Die einmalige postoperative intravesikale Chemotherapie mit Mitomycin C reduziert das Risiko für ein Rezidiv durch Tumorzellaussaat in der Harnblase (OBrien u.a., 2011) und ist auch nach organerhaltenden Eingriffen eine Therapieoption. Eine Extravasation sollte per Zystogramm ausgeschlossen werden.
Therapie des Hochrisiko-Urothelkarzinoms des oberen Harntrakts
Neoadjuvante Chemotherapie:
In retrospektiven Studien und im Analogieschluss zum Harnblasenkarzinom zeigen sich Vorteile für eine neoadjuvante Chemotherapie, auch angesichts der limitierten Möglichkeit für eine cisplatin-haltigen Chemotherapie nach Nephroureterektomie (Porten u.a., 2014). Indikationen sind organüberschreitendes Wachstum oder V.a. Lymphknotenmetastasen. Indikation, Durchführung und Ergebnisse siehe Harnblasenkarzinom/Chemotherapie.
Adjuvante Chemotherapie:
Für die adjuvante Chemotherapie nach Nephroureterektomie (bei Patienten mit pT2–4 oder pN+) konnte eine randomisierte Studie deutliche Vorteile belegen: 71% vs. 46% progressionsfreies Überleben nach drei Jahren. Patienten mit ausreichender Nierenfunktionen erhielten Cisplatin und Gemcitabin, bei eingeschränkter Nierenfunktion wurde Carboplatin verabreicht (Birtle u.a., 2020).
Radikale Nephroureterektomie:
Die radikale Nephroureterektomie ist die Methode der Wahl bei Urothelkarzinomen des oberen Harntrakts. Bei eingeschränkter Nierenfunktion und gut differenzierten Urothelkarzinomen sind organerhaltende Techniken (s.u.) zu erwägen. Wichtig ist neben der Tumornephrektomie die Entfernung des distalen Harnleiters mit einer Harnblasenmanschette, da sonst in 30 % ein Stumpfrezidiv auftreten kann.
Neoadjuvante oder adjuvante Chemotherapie:
In retrospektiven Studien und im Analogieschluss zum Harnblasenkarzinom zeigen sich Vorteile für eine neoadjuvante Chemotherapie, auch angesichts der limitierten Möglichkeit für eine cisplatin-haltigen Chemotherapie nach Nephroureterektomie (Porten u.a., 2014). Indikationen sind organüberschreitendes Wachstum oder V.a. Lymphknotenmetastasen. Indikation, Durchführung und Ergebnisse siehe Harnblasenkarzinom/Chemotherapie.
Zugangsmöglichkeiten für eine Nephroureterektomie:
Retroperitoneale abdominelle Inzision von der 11. Rippe bis suprapubisch, zwei getrennte Inzisionen (Flankenschnitt und z. B. Unterbauchschrägschnitt), laparoskopische Nephroureterektomie und z. B. Unterbauchschrägschnitt zur Ureterektomie und Organbergung (Matin, 2005). In retrospektiven Vergleichen zeigt die laparoskopische Operationstechnik eine geringere Komplikationsrate und kürzere Krankenhausverweildauer (Hanna u.a., 2012). Bei fortgeschrittenen Tumoren (T3--4) und bei high-grade Tumoren zeigte sich in einer randomisierten Studie bei der offen-chirurgischen Technik weniger Rezidive und Metastasen (Simone u.a., 2009). Technik siehe Kapitel Operationsverfahren/Nephroureterektomie.
Lymphadenektomie bei Nephroureterektomie:
Je nach Tumorlokalisation wird die Lymphadenektomie im Lymphabflussgebiet des Tumors durchgeführt: aortale, interaortocavale oder cavale Lymphadenektomie bei proximalen und mittleren Ureterkarzinomen und eine pelvine Lymphadenektomie bei distalen Ureterkarzinomen. In retrospektiven Analysen verbessert eine Lymphadenektomie die Prognose (Lenis u.a., 2018).
Postoperative intravesikale Chemotherapie:
Die einmalige postoperative intravesikale Chemotherapie nach Nephroureterektomie mit Mitomycin C kann das Rezidiv durch Tumorzellaussaat in der Harnblase reduzieren (absolute Risikoreduktion um 11%) (O'Brien u.a., 2011).
Chemotherapie bei fortgeschrittenem Urothelkarzinom:
Indikation, Durchführung und Ergebnisse siehe Kapitel Harnblasenkarzinom/Chemotherapie. Bei Knochemetastasen Biphosphonattherapie (Zoledronsäure).
Nachsorge des Urothelkarzinom des oberen Harntrakts
Die Nachsorgeuntersuchungen sollten über mindestens 5 Jahre durchgeführt werden, um metachrone Harnblasenkarzinome, Lokalrezidive oder Fernmetastasen zu diagnostizieren. Die EAU-Leitlinien differenzieren zwischen einem low-risk und high-risk UTUC, ein hohes Rezidivrisiko besteht bei dem Vorliegen von einem Risikofaktor: Tumorgröße >2 cm, high-grade Pathologie, multifokale Manifestation, Z.n. Zystektomie bei Harnblasenkarzinom.:
Nachsorge nach Nephroureterektomie und low-risk Tumor:
Zystoskopie nach drei Monaten und dann jährlich. CT von Abdomen und Thorax jährlich.
Nachsorge nach Nephroureterektomie und high-risk Tumor:
Zystoskopie (und Urinzytologie) alle drei Monate in den ersten zwei Jahren, dann halbjährlich und ab dem 6. Jahr jährlich. CT Abdomen und Thorax halbjährlich für zwei Jahre und dann jährlich.
Nachsorge bei organerhaltenden Verfahren:
Zystoskopie, Urinzytologie und CT-Abdomen nach drei Monaten, sechs Monaten und dann jährlich. CT-Thorax, und Spülzytologie individuell je nach Bildgebung und Risiko.
Prognose des Urothelkarzinoms von Harnleiter und Nierenbecken
5JÜR in Abhängigkeit vom Tumorstadium:
T1 60–90 %, T2 43–75 %, T3 16–33 %, T4 unter 5 %. Bei Lymphknotenmetastasen oder Fernmetastasen unter 5 %.
5JÜR in Abhängigkeit vom Grading:
40–87 % bei G1–2 Tumoren, 0–33 % bei G3 Tumoren.
| Harnleiterkarzinom 1/2 | Suchen | Urachus Fehlbildungen |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur Urothelkarzinom des Harnleiters und Nierenbeckens
EAU guidelines: Urothelkarzinom des oberen Harntrakts
A. Birtle et al., “Adjuvant chemotherapy in upper tract urothelial carcinoma (the POUT trial): a phase 3, open-label, randomised controlled trial.,” Lancet, vol. 395, no. 10232, pp. 1268–1277, 2020, doi: 10.1016/S0140-6736(20)30415-3.
Browne u.a. 2005 BROWNE, R. F. ; MEEHAN,
C. P. ; COLVILLE, J. ; POWER, R. ; TORREGGIANI,
W. C.:
Transitional cell carcinoma of the upper urinary tract: spectrum of
imaging findings.
In: Radiographics
25 (2005), Nr. 6, S. 1609–27
Chew u.a. 2005 CHEW, B. H. ; PAUTLER, S. E. ;
DENSTEDT, J. D.:
Percutaneous management of upper-tract transitional cell carcinoma.
In: J Endourol
19 (2005), Nr. 6, S. 658–63
Hanna, N.; Sun, M.; Trinh, Q.; Hansen, J.; Bianchi, M.;
Montorsi, F.; Shariat, S. F.; Graefen, M.; Perrotte, P. & Karakiewicz, P.
I.
Propensity-score-matched comparison of perioperative outcomes
between open and laparoscopic nephroureterectomy: a national series.
Eur
Urol, 2012, 61, 715-721.
Ho und Chow 2005 HO, K. L. ; CHOW, G. K.:
Ureteroscopic resection of upper-tract transitional-cell carcinoma.
In: J Endourol
19 (2005), Nr. 7, S. 841–8
Matin 2005 MATIN, S. F.:
Radical laparoscopic nephroureterectomy for upper urinary tract
transitional cell carcinoma: current status.
In: BJU Int
95 Suppl 2 (2005), S. 68–74
O'Brien, T.; Ray, E.; Singh, R.; Coker, B.; Beard, R. &
of Urological Surgeons Section of Oncology, B. A.
Prevention of bladder
tumours after nephroureterectomy for primary upper urinary tract
urothelial carcinoma: a prospective, multicentre, randomised clinical
trial of a single postoperative intravesical dose of mitomycin C (the
ODMIT-C Trial).
Eur Urol, 2011, 60, 703-710.
S. Porten et al., “Neoadjuvant chemotherapy improves survival of patients with upper tract urothelial carcinoma.,” Cancer, vol. 120, no. 12, pp. 1794–1799, 2014, doi: 10.1002/cncr.28655.
Tawfiek und Bagley 1997 TAWFIEK, E. R. ; BAGLEY,
D. H.:
Upper-tract transitional cell carcinoma.
In: Urology
50 (1997), Nr. 3, S. 321–9
 English Version: upper tract urothelial cancer
English Version: upper tract urothelial cancer
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.