Sie sind hier: Startseite > Nieren > chronische Niereninsuffizienz > Nierentransplantation
Nierentransplantation: Indikation, Organspende, Operation und Immunsuppression
 |
Die Nierentransplantation ist eine Nierenersatztherapie für Patienten mit terminaler Niereninsuffizienz, welche das Überleben und die Lebensqualität im Vergleich zur Hämodialyse deutlich verbessert (Halloran, 2004) (Perico u.a., 2004). Leitlinien der EAU.
Epidemiologie der terminalen Niereninsuffizienz
Prävalenz der Nierentransplantation: ungefähr 27% der terminal niereninsuffizienten Patienten in Deutschland sind mit einer Nierentransplantation versorgt, dies entspricht einer Prävalenz von etwa 30/100000 Einwohner.
Ätiologie der terminalen Niereninsuffizienz
Diabetische Nephropathie 23 %, Glomerulonephritis 23 %, interstitielle Nephritis (bakteriell) 12 %, vaskuläre Nephropathie 10 %, Zystennieren 8 % [siehe Chronische Niereninsuffizienz].
Kontraindikationen für eine Nierentransplantation
Infektionen:
Akute bakterielle oder virale Infektionen, chronische Parodontitis, Divertikulitis, Cholezystitis, HIV, chronische Pyelonephritis (Nephrektomie notwendig). Nicht sanierbare Infektionen wie aktive Tuberkulose oder aktive chronische Hepatitis sind absolute Kontraindikationen.
Malignome:
Je nach Tumorstadium oder Tumorbiologie wird ein krankheitsfreies Intervall von mindestens 2 Jahren gefordert. Metastasen sind eine absolute Kontraindikation.
Systemerkrankungen:
Fortgeschrittene Herz-, Lungen- oder Leberinsuffizienz.
Positive Cross-Match-Untersuchung:
Nachweis von transplantationsrelevanten zirkulierenden Antikörpern beim Empfänger, die gegen Spenderantigene gerichtet sind.
Indikation zur Nephrektomie vor Transplantation:
Eine Nephrektomie der Eigennieren vor Nierentransplantation ist indiziert bei schwere renal bedingte arterielle Hypertonie, chronische Pyelonephritis (mit oder ohne vesikoureteralen Reflux), Analgetikanephropathie, starke Proteinurie, symptomatische Zystennieren, Nephrolithiasis, Nierentumoren mit V.a. Nierenzellkarzinom.
Lebendnierenspende
Bedingungen für eine Lebendspende:
Der Empfänger muss für eine Nierentransplantation geeignet und auf die Warteliste aufgenommen sein. Verwandtschaft oder eine emotionale Nähe zum Empfänger sind notwendig. Eine kommerzielle Spende muss ausgeschlossen werden, ebenso die psychologische Abhängigkeit des Spenders vom Empfänger.
Eine gute Gesundheit und zwei gesunde Nieren sind beim Spender grundsätzlich zu fordern. Für die Diagnostik vor Lebendspende siehe Tab. Diagnostik vor Lebendspende:
| Diagnostik vor Nierenlebendspende | |
| Urin | Ausschluss von Harnwegsinfektion, Proteinurie und Hämaturie im 24 h-Sammelurin. |
| Labor | Großes Routinelabor inklusive Glukosetoleranztest. Blutgruppenantigene, Kreuzprobe (cross-matching). Serologie von HIV, HCV, HBV, CMV, EBV, Syphilis, Toxoplasmose. |
| Internistische Untersuchungen | Ausschluss von signifikanten internistischen Erkrankungen wie Herz- und Lungenerkrankungen, Diabetes mellitus, Tumorerkrankungen und chronische Infektionen. |
| Urologische Untersuchungen | Ausschluss von Miktionsstörungen und Tumoren, MRT- oder Spiral-CT-Angiographie zur Beurteilung der Anatomie und zum Ausschlus von Krankheiten von Niere und Harntrakt, Nierenszintigraphie: Bestimmung der seitengetrennten Kreatinin-Clearance. |
Für Kontraindikationen der Lebendspende siehe Tab. Kontraindikationen Lebendspende:
| Absolute Kontraindikationen |
| Alter unter 18 Jahre |
| Diabetes mellitus |
| Unkontrollierter arterieller Hypertonus |
| Proteinurie (>300 mg/24 h) |
| GFR unter 70 ml/min/1,75 m2 |
| Nephrolithiasis mit Rezidivrisiko [siehe Tabelle] |
| Erhöhtes Thrombembolierisiko |
| Signifikante internistischen Erkrankungen |
| BMI >35 kg/m2 |
| HIV-Infektion |
| Schwangerschaft |
| Tumorerkrankungen mit krankheitsfreiem Intervall <5–10 Jahre |
| Relative Kontraindikationen |
| Chronische Infektionen (Tbc, Hep B/C) |
| BMI >30 kg/m2 |
| Psychische Erkrankungen |
| Mikrohämaturie ohne sichtbare Nierenerkrankung |
Es wird immer die schwächere Niere für eine Lebendspende verwendet. Obligat ist eine negative Kreuzprobe (cross-matching) zwischen Spender und Empfänger. Die HLA-Ähnlichkeit oder -Übereinstimmung ist nicht obligat, da HLA-inkompatible Nierentransplantate eine akzeptable Langzeitfunktion von 56% nach 10 Jahren zeigen. Bezüglich der Blutgruppenantigene reicht für die Nierenspende eine Blutgruppenkompatibilität [siehe auch Tab. AB0-Kompatibilität]. Es existieren auch Protokolle für eine intensivierte Immunsuppression für AB0-inkompatible Nierentransplantationen. Um trotzdem eine Lebendspende zwischen AB0-inkompatiblen Spender und Empfänger zu ermöglichen, gibt es Programme mit Überkreuzspende in einer Region (paired donation). Das deutsche Transplantationsgesetz sieht keine Möglichkeit der Überkreuzspende vor.
Risiko der Lebendspende für den Spender:
Mortalität 0,03–0,06%, schwere Komplikationen 2–4%. Insgesamt bis zu 30% Komplikationen, am häufigsten Pneumonie, Harnwegsinfektion, Wundinfektion, Pneumothorax, Ileus, Hämatom, Narbenbruch, prolongierte Schmerzen, Thrombose und Embolie (Kasiske u.a., 1996).
Technik der Organentnahme:
Flankenschnitt, laparoskopischer oder retroperitoneoskopischer Zugang. Darstellung der Nierengefäße und Absetzen des Ureters unterhalb der Gefäßkreuzung. Absetzen der Gefäße nahe an den großen Gefäßen und Organentnahme. Präparation und Perfusion mit kalter Lösung ex situ.
Postmortale Nierenspende
Bedingungen für eine Organentnahme:
Bei nachgewiesenem Hirntod, bestätigt von zwei unabhängigen Ärzten, kann eine Organentnahme erwogen werden. Weiterhin notwendig ist eine Einwilligung für die Organspende durch den Patienten (Organspendeausweis) oder Angehörige.
Organspende nach Herztod:
In einigen Ländern (Großbritannien, Schweiz, Niederlanden, Spanien, Belgien und USA) genügt für die endgültige Todesfeststellung ein Herz- und Kreislaufstillstand von 10 min bei normaler Körpertemperatur, danach gilt die Hirnfunktion als unwiederbringlich verloren. Eine Nierenspende von "non heart-beating donors (NHBD)" ist dann innerhalb von 60–120 min erfolgreich möglich, die Langzeitergebnisse sind vergleichbar mit Organspenden nach Hirntod. In Deutschland ist die Transplantation von Organen nach Herztod aufgrund von ethischen Überlegungen und dem Risiko von Fehldiagnosen nicht erlaubt (Weiller u.a., 2014).
Kontraindikationen für eine Organentnahme:
Metastasierungsfähige Malignome, übertragbare Infektionen (Hepatitis, HIV, Tuberkulose, Sepsis, Risikoprofil für eine übertragbare Infektionen wie z. B. Drogenabusus). Das Kreatinin sollte unter 2 mg/dl liegen.
Auswahl des Empfängers für eine Nierentransplantation:
Von Eurotransplant in Leiden (Niederlande) werden anhand der verfügbaren biochemischen Eigenschaften des Transplantates geeignete Empfänger in Mitteleuropa ausgewählt. Neben der Blutgruppeneigenschaften spielen die Antigene des HLA-Systems eine wichtige Rolle. Weiterhin werden die Wartezeit, das Alter des Empfängers, die Qualität des Spenderorgans und die Dringlichkeit berücksichtigt. Eurotransplant kooperiert mit anderen vergleichbaren Organisationen in Europa. Dies ermöglicht die optimale Verteilung der erhältlichen Organe. Wenn die Organqualität einer einzelnen Niere als zu schlecht beurteilt wird, so existiert die Möglichkeit der dualen Nierentransplantation: zwei grenzwertige Nieren werden gemeinsam transplantiert.
Kidney Donor Profil Index (KDPI):
Der KDPI beschreibt die Organqualität eines Spenders und korreliert mit dem Transplantatüberleben, als Faktoren werden Alter, Größe, Gewicht, Ethnie, arterieller Hypertonus, Diabetes, Todesursache, Serumkreatinin, Hepatitis C-Status und Spende nach Herztod verwendet. Der KDPI wird in den USA zur Verteilung genutzt: sehr gute Spendernieren werden an Patienten mit langer Lebenserwartung verteilt, Organe mit einem schlechten KDPI sind immer noch eine gute Option für ältere komorbide Patienten.
Spendernierenbiopsie:
Die Spendernierenbiopsie (engl. procurement biopsy) kann die Organqualität vor Transplantation einschätzen und wird in den USA regelmäßig praktiziert. Indikationen sind Spender mit dem Risiko einer Nierenfunktionsstörung wie Anurie, Kreatinin über 1,5 mg/dl, Diabetes mellitus, KDPI über 85% oder Alter über 60 Jahre. Problematisch sind der Zeitdruck, die uneinheitliche Beurteilung von histologischen Veränderungen und die Ungenauigkeit (Schnellschnitt, fehlende Erfahrung des Pathologens). Die Ergebnisse der Spendernierenbiopsie sind in den USA der häufigste Grund für das Verwerfen einer Spenderniere.
Technik der Organentnahme:
Transperitoneale Nierenfreilegung. Darstellung der Aorta und V. cava vom Zwerchfell bis zur Bifurkation. Ligatur der A. mesenterica inf. und superior, A. iliaca communis bds. und V. cava auf Höhe der Bifurkation. Einlage eines Perfusionskatheters in die Aorta und eines Ablaufkatheters in die V. cava. Nach dem Abklemmen der Aorta und V. cava unterhalb des Zwerchfells werden die Nieren mit 4 Grad kalter Perfusionslösung gespült. Durchtrennung der Harnleiter unterhalb der Gefäßkreuzung und Präparation bis Nierenunterpol unter Schonung der periureteralen Gefäße. Durchtrennung von Aorta und V. cava oberhalb und unterhalb der Nierengefäße und Entnahme beider Nieren mit Nebennieren und Fettkapsel. Ex situ wird unter Kühlung die Nierenfettkapsel entfernt und die Nierengefäße mit Aorten- und Cavawand (Manschette) präpariert.
Technik der Nierentransplantation
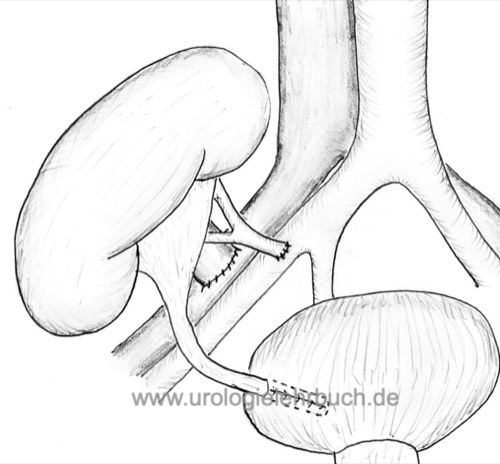
Retroperitonealer Zugang zu den Beckengefäßen über einen Pararektalschnitt. Schonender Umgang mit den Lymphgefäßen. Die linke Niere wird meist auf die rechte Gefäßachse und umgekehrt transplantiert [Abb. Schematische Abbildung einer Nierentransplantation]. Die Vene wird vor der Arterie anastomosiert. Als Anschluss für die Anastomose (End-zu-Seit) werden meistens die A. und V. iliaca communis verwendet. Der Ureter wird nach Einlage einer Harnleiterschiene entweder transvesikal (Technik nach Leadbetter-Politano) oder extravesikal (eine Art Lich-Gregoir nach Anastomose des Ureters mit der Harnblasenschleimhaut) implantiert. Es werden auch refluxive Anastomosentechniken verwendet.
Komplikationen der Nierentransplantation:
Blutung, Wundinfektion, arterielle oder venöse Thrombose des Transplantats mit Funktionsverlust, Lymphozele, Urinom, Ureterstenose, vesicoureteraler Reflux, Pyelonephritis, Nierensteine, hyperakute, aktive oder chronische Abstoßungsreaktionen (T-Zell oder antikörpervermittelt).
Immunsuppression nach Nierentransplantation
Prinzipiell werden zur Immmunsuppression nach Nierentransplantation folgende Substanzgruppen eingesetzt:
- Glukokortikoide
- Calcineurin-Inhibitoren: Ciclosporin, Tacrolimus
- mTOR-Inhibitoren: Sirolimus, Everolimus
- Purin Synthese (IMPDH) Inhibitoren: Mycophenolat-Mofetil
- Antimetaboliten: Azathioprin
- Antikörper gegen T- und B-Lymphozyten: Lymphozyten-dezimierende Antikörper wie polyklonaler AK (antithymocyte globulin), monoklonaler anti-CD3 AK (Muromonab-CD3), monoklonaler anti-CD52 AK (Alemtuzumab). Lymphozyten-schwächende Antikörper wie monoklonaler anti-CD25 AK (Daclizumab, Basiliximab) und B-Zell-schwächender monoklonaler anti-CD20 AK (Rituximab).
Protokolle für die Immunsuppression:
Die immunsuppressive Therapie wird folgende Phasen eingeteilt:
Induktionstherapie:
Die Induktionstherapie ist eine immunsuppressive Therapie vor NTX, zur Anwendung kommen u.a. die Plasmapherese zur Elimination von zirkulierenden Antikörpern und die Gabe von Antikörpern gegen Immunzellen.
Initialtherapie:
Immunsuppression bis zu drei Monate nach NTX, verwendet werden Kombinationen aus einem Calcineurininhibitor (Ciclosporin oder Tacrolimus), kombiniert mit Mycophenolat-Mofetil und ein Cortisonpräparat. Alternativen sind Kombinationstherapien mit mTOR-Inhibitoren.
Eine zusätzliche Gabe von Antikörpern gegen Immunzellen ist optional und wird empfohlen bei Patienten mit einer verzögerten Transplantatfunktion oder bei Patienten mit erhöhtem Risiko für eine Abstoßung (HLA-Antikörper).
Erhaltungstherapie:
Die Immunsuppressiva werden nun reduziert. Verwendet werden Calcineurin-Inhibitoren, ein zweites Immunsuppressivum wie Azathioprin oder Mycophenolat-Mofetil und Glukokortikoide. Abstoßungen werden mit hochdosierten Steroiden oder Antikörpern gegen Immunzellen behandelt.
Modifikationen:
Es existieren zahlreiche Modifikationen des traditionellen Protokolls: ohne Steroide, ohne Ciclosporin oder starke Induktionstherapie mit minimaler Immunsuppression im Verlauf.
Prognose nach Nierentransplantation
Lebendspende:
1– und 10–Jahres Transplantatfunktionsrate bei nicht verwandten Spendern (HLA-inkompatibel) beträgt 92 % und 56 %.
Postmortale Nierenspende:
1– und 10–Jahres Transplantatfunktionsrate beträgt 87 % und 50 %.
| Dialyse | Suchen | Nephrolithiasis |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur Nierentransplantation
Breda, A.; Olsburgh, J.; Budde, K.; Figueiredo, A.; Lledó García, L. & Regele, H. EAU Guideline: Renal Transplantation2019. https://uroweb.org/guidelines/renal-transplantation/
BTS & Renal Association UK Guidelines for living donor kidney transplantation, online abgerufen auf http://www.cambridge-transplant.org.uk/program/renal/lrdgui.pdf am 22.2.2011.
Halloran 2004 HALLORAN, P. F.: Immunosuppressive drugs for kidney transplantation.
In: N Engl J Med
351 (2004), Nr. 26, S. 2715–29
Perico u.a. 2004 PERICO, N. ; CATTANEO, D. ;
SAYEGH, M. H. ; REMUZZI, G.:
Delayed graft function in kidney transplantation.
In: Lancet
364 (2004), Nr. 9447, S. 1814–27
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.