Sie sind hier: Startseite > Hoden > Infertilität > Ursachen
Infertilität des Mannes: Ursachen der Unfruchtbarkeit
- Infertilität des Mannes: Ursachen und Diagnose
- Infertilität des Mannes: Therapie
Definitionen und Epidemiologie der Infertilität
Die Infertilität ist eine variabel definierte Erkrankung mit entsprechend unterschiedlichen epidemiologischen Daten. Meistens wird die Infertilität als das Ausbleiben einer Schwangerschaft trotz regelmäßigem ungeschützten Geschlechtsverkehr über ein Jahr definiert.
Die alte Unterscheidung zwischen Sterilität (Unmöglichkeit, ein Kind zu zeugen) und Infertilität (Unmöglichkeit, ein Kind auszutragen) besteht in der modernen Literatur nicht mehr, beide Begriffe werden synonym nebeneinander verwendet. In Prävalenzstudien bestehen erhebliche Unterschiede hinsichtlich der Dauer des unerfüllten Kinderwunsches (1–2 Jahre vs. lebenslang), der Datenerhebung (Fragebogen vs. prospektiv), der Erfolgsziele (Schwangerschaft vs. Lebendgeburt), des Beziehungsstatus und der Ausschlusskriterien (Gurunath u.a., 2011). Im klinischen Alltag ist es praktikabel, die Infertilität in Abhängigkeit des Zeitraums des unerfüllten Kinderwunsches und der Chancen für eine Schwangerschaft zu beurteilen (Gnoth u.a., 2005).
Subfertilität (Unerfüllter Kinderwunsch):
Der unerfüllte Kinderwunsch ist das Ausbleiben einer Schwangerschaft nach sechs Menstruationszyklen trotz regelmäßigem ungeschützten Geschlechtsverkehr. Die Prävalenz beträgt ungefäht 20%. Die Hälfte dieser Paare werden in den nächsten sechs Zyklen eine Schwangerschaft erreichen.
Infertilität:
Die Infertilität ist das Ausbleiben einer Schwangerschaft nach zwölf Menstruationszyklen trotz regelmäßigem ungeschützten Geschlechtsverkehr. Die Prävalenz beträgt ungefäht 10%. Etwa die Hälfte der Paare hat innerhalb von 36 Monaten die Aussicht auf eine Spontankonzeption, die andere Hälfte leidet unter definitiver Infertilität.
Oligo-Astheno-Teratozoospermie Syndrom:
Das OAT-Syndrom ist eine häufig gestellte Diagnose anhand eines Spermiogramms mit zu wenig, zu gering beweglichen und zu vielen pathologisch geformten Spermien. Siehe Abschnitt Spermiogramm und Abschnitt Diagnostik unten.
Azoospermie:
Fehlender Nachweis von Spermien im Ejakulat.
Sertoli cell-only Syndrom:
Kein Nachweis einer Spermatogenese bei der pathologischen Untersuchung einer Hodenbiopsie.
Ursachen (Ätiologie) der Infertilität
Bei Paaren mit Infertilität sind in 30% männliche Faktoren zu identifizieren; weibliche Ursachen der Infertilität beinhalten Ovulationsstörungen (25%), Tubenerkrankungen (20%), uterine or peritoneale Erkrankungen (10%). In etwa 40% sind männliche und weibliche Faktoren für Infertilität vorhanden, in 25% der Fälle sind keine Ursachen zu finden.
Unerklärte Infertilität:
In 25% der Fälle kann keine Ursache für Infertilität bei Mann und Frau gefunden werden (engl. unexplained infertility). Voraussetzungen für die klinische Diagnose ist die Subfertilität (12 Monate unerfüllter Kinderwunsch) und normale Standarduntersuchungen (Spermiogramm, Tubendurchgängigkeitstest und Untersuchung der Ovulation). Die Prognose ist günstig, etwa 50% der Paare werden innerhalb der nächsten 12 Monate eine Schwangerschaft erreichen, weitere 12% im folgenden Jahr (Gelbaya u.a., 2014).
Das Alter der Frau:
Das Alter der Frau ist ein Risikofaktor für Subfertilität, siehe Tab. Alter der Frau und Schwangerschaftsraten. Weiterhin ist das Alter der Frau ein Risikofaktor für den Erfolg der assistierten Reproduktionstechniken.
| Alter | Nach 1 Jahr | Nach 2 Jahren |
| 19–26 | 92% | 98% |
| 27–29 | 87% | 95% |
| 30–34 | 86% | 94% |
| 34–39 | 82% | 90% |
Chromosomale und genetische Krankheiten mit Infertilität des Mannes:
Etwa 20% der azoospermen Männer haben genetische oder chromosomale Ursachen, davon ist das Klinefelter-Syndrom am häufigsten.
- Chromosomale Erkrankungen:
- Klinefelter-Syndrom: numerischen Sexchromosomabberation mit einem zusätzlichen X-Chromosom (47,XXY) mit Azoospermie und hypergonadotropen Hypogonadismus.
- 46XX-Männer haben ebenfalls eine Azoospermie durch die fehlende Keimzellproduktion.
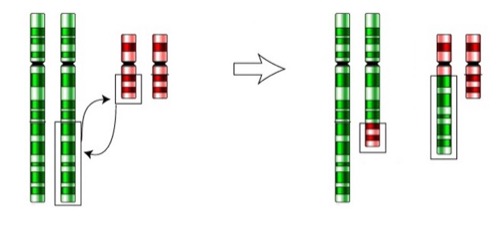
- Die chromosomale balancierte Translokation ist ein Austausch von Chromosomenarmen ohne Verlust von Genmaterial [Abb. Schemazeichnung einer balancierten Translokation]. Männer mit balancierter Translokation sind i.d.R. beschwerdefrei, haben häufig eine gestörte Fertilität (Oligozoospermie bis Azoospermie), da die Meiose durch die Translokation behindert wird. Wenn eine Fertilität vorliegt, besteht eine hohes Risiko von Zygoten mit unbalancierter Translokation (sehr hohe Fehlgeburtenrate, behinderte Kinder).
- Genetische und angeborene Erkrankungen:
- Y-chromosomale Mutationen des Azoospermie-Faktors: Mutationen von AZFa+b führen zur Azoospermie, histologisch liegt im Hoden immer ein Sertoli cell-only Syndrom vor. Bei Mutationen von AZFc besteht noch eine geringe Spermatogenese mit Oligozoospermie oder Azoospermie (aber die TESE ist eine Option um ICSI zu ermöglichen).
- minimales oder partielles Androgeninsensitivitätssyndrom
- 5α-Reduktase-Mangel
- adrenogenitales Syndrom.
- Genetisch bedingte bilaterale Aplasie des Vas deferens (CBAVD) durch Mutationen des CTFR-Gens
- Angeborener hypogonadotroper Hypogonadismus inkl. Kallmann-Syndrom
Hormonstörungen:
Je nach Ausprägung der Hormonstörung entsteht eine Subfertilität bis hin zu einer Azoospermie.
Hypogonadismus:
Siehe Abschnitt Hypogonadismus.
Weitere Hormonstörungen und Infertilität:
Östrogenüberschuss (Leberzirrhose, Adrenokortikales Karzinom, Hodentumoren), Androgeneinnahme (meist Sportler), Hyperprolaktinämie, Hyperkortisolismus, Hyperthyreose oder Hypothyreose.
Schwere Systemerkrankungen:
Führen u.a. zu einem primären Hypogonadismus und zur Infertilität (z.B. Leberzirrhose, Niereninsuffizienz oder Herz-Kreislauferkrankungen).
Testikuläre Ursachen der Unfruchtbarkeit:
Neben Ursachen des primären Hypogonadismus verursachen auch testikuläre Erkrankungen ohne Hypogonadismus eine Infertilität.
Testikuläre Schädigung durch Toxine oder Medikamente:
Strahlentherapie, Chemotherapie, Ketoconazol, Kalziumkanalblocker, Cimetidin, Spironolacton, Valproinsäure, Allopurinol, Alphablocker, trizyklische Antidepressiva, Drogen.
Kryptorchismus:
Die Ursache für die Keimzellschädigung bei Kryptorchismus ist unklar (genetische Faktoren, Hyperthermie) Eine frühzeitige Orchidopexie (vor dem zweiten Lebensjahr) ist wichtig, um das Risiko für eine spätere Infertilität zu reduzieren.
Hodentumoren:
Sowohl Keimzelltumoren oder Stromazelltumoren können die Ursache einer Infertilität sein. Vermutet werden gemeinsame ätiologische Faktoren für die Schädigung des Keimepithels. Zusätzlich kann die Hormonproduktion von Tumoren zu einer Infertilität führen.
Varikozele:
Die Varikozele verschlechtert die Spermienqualität durch Reflux von katecholaminhaltigen venösen Blut mit reaktiver Vasokonstriktion, weiterhin erhöhte Hodentemperatur durch erhöhte Durchblutung, venöse Stase und verminderte Testosteronproduktion durch Leydig-Zellen.
Infektionen:
Mumps-Orchitis, Hodenabszedierung oder Infektion bei bakterieller Epididymitis.
Mechanische Faktoren:
Hodentorsion oder Verletzungen des Hodens. Es besteht die Gefahr der immunologischen Schädigung der kontralateralen Seite.
Anorchidie:
Angeboren oder erworbener Verlust beider Hoden.
Posttestikuläre Ursachen:
Eine beidseitige Erkrankung der Samenwege führt zur Infertilität (obstruktive Azoospermie).
Fehlbildungen und Unfruchtbarkeit:
Genetisch bedingte bilaterale Aplasie des Vas deferens (CBAVD), Aplasie von Nebenhoden oder Samenblasen durch Mutationen des CFTR-Gens.
Young-Syndrom:
COPD, chronische Sinusitis und obstruktive Azoospermie. Die Ursache ist wahrscheinlich eine abnorme ziliäre oder muköse Funktion.
Obstruktion der Ductus ejaculatorii:
Durch Utrikuluszysten, Infektionen, Prostatasteine, Fibrosen, Spermatozelen, bei ADPKD...
Erworbene Obstruktion:
Vasektomie (5 % wünschen nach Vasektomie eine operative Reanastomose), Hernienchirurgie, Epididymitis.
Spermienfunktionsstörungen als Ursache der Unfruchtbarkeit:
Fehlerhafte Spermiengeißel oder Reifungsdefekte der Spermien.
Immobile Spermiengeißel:
Heterogene Gruppe von Erkrankungen mit fehlerhaftem Aufbau der Spermiengeißel: Defektes Dynein, Kartagener-Syndrom (Situs inversus, Bronchiektasen, Sinusitis), Usher-Syndrom (Retinitis pigmentosa, Taubheit), ...
Reifungsdefekte der Spermien:
Meist durch Erkrankungen des Nebenhodens oder nach Reanastomose nach einer Vasektomie.
Immunologische Ursachen der Infertilität:
Antikörper gegen Spermien werden durch die Blut-Hoden-Schranke verhindert. Nach Hodentrauma, Hodentorsion oder Vasektomie werden vermehrt Antikörper gegen Spermien gebildet. Die Häufigkeit von autoimmuner Infertilität wird auf 10 % geschätzt. Eine weitere Möglichkeit der immunogenen Infertilität sind Isoantikörper der Frau gegen Spermien.
Iatrogene Faktoren der Infertilität:
Chemotherapie, Strahlentherapie, Medikamente (Zytostatika, Immunsuppressiva, Kortikoide, Antidepressiva, Metoclopramid, Antibiotika, Antiepileptika), Samenstrangverletzung nach Herniotomie.
Umweltgifte:
Die abnehmende Fertilität (Spermiogramm) in Industrienationen spricht für Umweltgifte, welche neben Infertilität auch das Risiko für andere Krankheiten erhöhen (Hypospadie, Kryptorchismus, Frühgeburten, Hodentumoren). Als Auslöser werden zahlreiche Stoffe (endokrine Disruptoren) in Kunststoffen und Pestiziden diskutiert (DeToni u.a., 2019) (Rodprasert u. a., 2021).
Weitere Risikofaktoren für Infertilität:
Schwerer Nikotin- oder Alkoholabuses.
Sexuelle Störungen und Unfruchtbarkeit:
Falscher Zeitpunkt, falsche Frequenz oder falsche Sexualpraktiken können die Ursache für Infertilität sein, weiterhin auch Vorzeitige Ejakulation, retrograde Ejakulation und fehlende Ejakulation (Querschnittslähmung).
Basisdiagnostik bei unerfülltem Kinderwunsch
Als Basisuntersuchung für Männer in Partnerschaften mit Subfertilität (z.B. Kinderwunsch über 12 Monate) ist die Anamnese, körperliche Untersuchung, Sonographie der Hoden und ein Spermiogramm ausreichend. Bei pathologischen Befunden werden weiterführende u.g. Untersuchungen angeschlossen.
Anamnese:
Vorbestehende Schwangerschaften oder Aborte in früheren Partnerschaften, Ejakulationsstörungen, falscher Zeitpunkt oder Frequenz des Geschlechtsverkehrs, Medikamente, Kinderkrankheiten (Mumpsorchitis), Epididymitiden, Hodenoperationen, Prostataoperationen, Nikotin, Alkohol, Drogen, Androgensubstitution oder -missbrauch, systemische Erkrankungen, genetische Erkrankungen, Umweltbelastungen (Blei, ionisierende Strahlung, Chemikalien).
Körperliche Untersuchung:
Bestimmung des Hodenvolumens mit Hilfe eines Orchidometers (normal 18 ml +/- 5 ml), Identifizierung des Samenleiters durch Palpation. Die weitere körperliche Untersuchung fandet nach pathologischen Befunden wie Varikozele, Epididymitis, Leistenhoden, Hodentumor, Meatusstenose, Hypospadie, Behaarungsmuster, Gynäkomastie.
Sonographie des Hodens:
Ultraschall des Hodens: Hodenvolumen? Hodentumoren? Varikozele?
Spermiogramm:
Bestimmung von Volumen, Konsistenz, pH-Wert, Fructose, Spermatozoenanzahl, Motilität, Vitalität, Morphologie, Entzündungszeichen. Normwerte siehe Kapitel Urologische Untersuchungen/Spermiogramm. Bei einem pathologischem Ergebnis sollte die Untersuchung nach drei Monaten wiederholt werden. Bestätigen sich schwergradige Störungen im Spermiogramm (Azoospermie, Kryptozoospermie, komplette Asthenozoospermie), ist dies diagnostisch für die männliche Infertilität. Bei wiederholt pathologischen Ergebnissen im Spermiogramm sind weitere Untersuchungen sind notwendig (s.u.). Die Bedeutung von geringgradigen Anomalien im Spermiogramms ist limitiert, eine Fruchtbarkeit ist trotzdem möglich. Aktuell existieren keine zuverlässigen Spermienfunktionstests.
Asthenozoospermie:
Der Anteil an progressiv motilen Spermatozoen liegt unter 32%.
Kryptozoospermie:
Fehlender Nachweis von Spermien im Nativpräparat, nach Zentrifugation sind jedoch (wenige) Spermien im Sediment nachweisbar.
Azoospermie:
Fehlender Nachweis von Spermien im Nativpräparat und nach Zentrifugation des Ejakulates und Beurteilung des Sedimentes.
Nekrozoospermie:
Ein Anteil toter Spermien über 42%.
Oligozoospermie:
<15× 106 pro ml Ejakulat oder <39× 106 Spermatozoen absolut.
Pyospermie:
Mehr als 106 Leukozyten/ml Ejakulat. Eine Harnwegsinfektion sollte ausgeschlossen sein. Der Nachweis von >103 Bakterien/ml Ejakulat spricht für eine signifikante Bakteriospermie.
Teratozoospermie:
Weniger als 4% Spermien mit normaler Morphologie.
Kombinierte Diagnosen:
Asthenoteratozoospermie, Oligoasthenozoospermie, Oligoasthenoteratozoospermie (OAT-Syndrom), Oligoteratozoospermie.
Weiterführende Diagnostik bei unerfülltem Kinderwunsch
Bei Auffälligkeiten bei o.g. Basisuntersuchungen ist die weiterführende Diagnostik zur Ursachenforschung des unerfüllten Kinderwunsches notwendig.
TRUS:
Die transrektale Sonographie der Prostata ist indiziert bei Azoospermie oder niedrigem Samenvolumen. Der Nachweis einer verbreiterten Samenblase (>1,5 cm) oder von verbreiterten Ductus ejaculatorii (>2,5 mm) sind verdächtig für eine obstruktive Samenwegserkrankung. Fehlende Samenblasen sprechen für eine CBAVD. Zysten, Verkalkungen und Prostatasteine sind ein Hinweis für eine mögliche Obstruktion der Ductus ejaculatorii.
Laboruntersuchungen bei Kinderwunsch des Mannes:
Endokrinologische Tests sind bei pathologischem Spermiogramm, erektiler Dysfunktion oder verminderter Libido indiziert. Initial werden Testosteron und FSH bestimmt, durch pathologische Werte dieser zwei Hormone werden 99 % der Hormonstörungen empfindlich erfasst. Bei pathologischen Werten werden weitere Parameter ermittelt: SHBG, Prolaktin, Gonadotropine LH und FSH, TSH. Ein GnRH-Test ist bei erniedrigten Gonadotropinen indiziert. FSH ist bei einem Keimzellschaden (nicht obstruktiver Azoospermie) durch fehlende Rückkopplung über Inhibin erhöht. Ein stark erhöhtes FSH in Kombination mit kleinen Hoden und Azoospermie sind hinweisend für eine nicht behandelbare Störung der Spermiogenese.
DNA Fragmentation Index (DFI):
Messparameter für das Ausmaß von DNA-Schäden (wie Brüche des DNA Einzelstranges oder Doppelstranges) in den Spermien, dies wird mit Hilfe eines normalen Spermiogramms nicht erfasst. Die DNA-Fragmentation entsteht durch oxidativen Stress und fehlerhaften Reifungsvorgänge in den ableitenden Samenwegen. Testikulär entnommene Spermien weisen deutlich weniger DNA-Framentierung auf. Es existieren unterschiedliche Labormethoden, welche nicht untereinander vergleichbar sind: TUNEL (terminal deoxynucleotidyl transferase deoxyuridine triphosphate nick end labeling (TUNEL), comet test (COMET) oder sperm chromatin structure assay (SCSA). Je höher die DNA Fragmentierung (>30%), desto schlechter die Fruchtbarkeitsparameter wie Befruchtung, Entwicklung des frühren Embryo und Implantation und Abortrate. Bei Paaren mit hoher DNA Fragmentation ist die spontane Erfüllung des Kinderwunsches unwahrscheinlich. Bei gewünschter assistierter Reproduktion sollte auf IVF verzichtet werden, erfolgsversprechender ist dann ICSI mit testikulär gewonnenen Spermien (Esteves u.a., 2017).
Chromosomenanalyse:
Je niedriger die Spermienkonzentration, desto häufiger werden Veränderungen im Karyogramm gefunden. Die Leitlinien empfehlen ein Karyogramm bei Männern mit Azoospermie oder schwergradiger Oligozoospermie (EAU Leitlinie <10×106 und AUA Leitlinie <5×106 Spermatogonien).
Häufigster pathologischer Befund im Karyogramm ist ein Klinefelter-Syndrom (46,XXY). Weitere mögliche Befunde sind chromosomale Translokationen und seltener Erkrankungen wie 46,XX Männer.
Y-chromosomale Mutationen:
Nachweis von Mutationen auf dem langen Arm des Y-Chromosoms (AZF-Region). Indiziert bei Männern mit Azoospermie oder schwergradiger Oligozoospermie (EAU Leitlinie <1×106 und AUA Leitlinie <5×106 Spermatogonien).
CFTR-Mutationen:
Die Suche nach CFTR-Mutationen ist indiziert bei unfruchtbaren Männern ohne tastbaren Samenleiter auf beiden Seiten (siehe auch CBAVD). 80% der Männer ohne nachweisbaren Ductus deferens haben Mutationen im Gen für Mukoviszidose.
Hodenbiopsie:
Die Hodenbiopsie ist indiziert bei Azoospermie, normaler Hodengröße und normalem FSH. Die Hodenbiopsie sollte immer mit Kryokonservierung von Hodengewebe oder Spermien erfolgen, wenn ICSI geplant ist, um einen zweiten Eingriff zu vermeiden. Siehe Abschnitt kontralaterale Hodenbiopsie zur Technik der offenen Hodenbiopsie. Eine Alternative zur offenen Hodenbiopsie ist die mehrfache perkutane Aspirationszytologie von Hodengewebe.
Nicht hilfreich ist die Hodenbiopsie bei Krankheiten mit gesicherter fehlender Spermatogenese: Klinefelter-Syndrom, 46XX-Männer und nachgewiesende (AZFa+b) Mutationen des Azoospermie-Faktors. Bei Nachweis von AZFc Mutationen kann eine Hodenbiopsie nach genetischer Beratung versucht werden.
Kinderwunsch-Diagnostik bei der Partnerin:
Die Basisuntersuchung erfasst Anomalien des Menstruationszyklus und der Ovulation mit Sonographie und Bestimmung von LH, FSH und Progesteron. Weiterhin wird die Durchgängigkeit der Tuben mit der Hysterosalpingographie oder mit Laparoskopie und Chromopertubation überprüft. Die Interaktion zwischen Spermien und Zervixschleim kann mit Hilfe des Postkoitaltests und Kurzrock-Miller Test untersucht werden (s.u.), diese Tests kommen aufgrund unsicherer Aussagen und fehlender Standardisierung immer seltener zur Anwendung.
Postkoitaltest (Sims-Huhner-Test):
Der Postkoitaltest wird am Tage der vermuteten Ovulation (5 cm Spinnbarkeit des Schleims, hoher Zervix-Score nach Insler) und etwa 2–10 h nach Geschlechtsverkehr durchgeführt. Zervikalschleim wird aus dem Zervikkanal entnommen und über einem Objektträger ausgestrichen. Normal ist der Nachweis von >1 progressiv beweglichem Spermatozoen pro Gesichtsfeld. Bei pathologischem Ergebnis kann das Einbringen von Sperma in das Cavum uteri erfolgversprechend sein.
Kurzrock-Miller-Test:
In-vitro Test zur Beurteilung der Interaktion zwischen Zervixschleim und Spermien, insbesondere nach pathologischem Postkoitaltest. Auf einem Objekträger werden Zerixschleim und Spermien nebeneinander aufgestrichen. Normalerweise penetrieren die Spermien das Areal des Zervixschleims und bleiben beweglich (positives Testergebnis). Pathologisch ist der Test wenn der Zerixschleim nicht penetriert wird oder die Spermien im Schleim unbeweglich werden.
Spermienpenetrationstest (SPA):
Der Spermienpenetrationstest untersucht die Fähigkeit von humanen Spermien für die Penetration einer Hamstereizelle. Der Test hat keine Bedeutung in der klinischen Praxis.
| Varikozele | Suchen | Therapie Unfruchtbarkeit |
Sachregistersuche: A B C D E F G H I J K L M N O P Q R S T U V W X Y Z
Literatur
H. Cuppens and J. J. Cassiman, “CFTR mutations and polymorphisms in male infertility,” Int J Androl, vol. 27, no. 5, pp. 251–6, 2004.
S. C. Esteves, M. Roque, C. K. Bradley, and N. Garrido, “Reproductive outcomes of testicular versus ejaculated sperm for intracytoplasmic sperm injection among men with high levels of DNA fragmentation in semen: systematic review and meta-analysis.,” Fertil Steril, vol. 108, no. 3, pp. 456–467, 2017.
Gurunath, S.; Pandian, Z.; Anderson, R. A. &
Bhattacharya, S.
Defining infertility--a systematic review of
prevalence studies.
Hum Reprod Update 2011, 17, 575-588
Gnoth, C.; Godehardt, E.; Frank-Herrmann, P.; Friol,
K.; Tigges, J. & Freundl, G.
Definition and prevalence of
subfertility and infertility.
Hum Reprod, 2005, 20,
1144-1147
G. Haidl, H. C. Schuppe, F. M. Köhn, and C. Leiber, “[Evidence-based drug therapy for male infertility],” Urologe A, vol. 47, no. 12, pp. 1555–6, 1558–60, 2008.
Hendry u.a. 2001 HENDRY, W. ; MEULEMAN, E. ;
POMEROL, J. ; PRYOR, B.:
Infertility: Urological Aspects.
In: Eur Urol
40/6 (2001)
J. L. Marmar et al., “Reassessing the value of varicocelectomy as a treatment for male subfertility with a new meta-analysis.,” Fertil Steril, vol. 88, no. 3, pp. 639–648, 2007.
J. Paick, S. H. Kim, and S. W. Kim, “Ejaculatory duct obstruction in infertile men,” BJU Int, vol. 85, no. 6, pp. 720–4, 2000.
W. Rodprasert, J. Toppari, and H. E. Virtanen, “Endocrine Disrupting Chemicals and Reproductive Health in Boys and Men.,” Front Endocrinol., vol. 12, p. 706532, 2021.
A. Salonia, S. Minhas, and C. Bettocchi, “EAU Guidelines: Sexual and Reproductive Health,” 2022. [Online]. Available: https://uroweb.org/guidelines/sexual-and-reproductive-health/.
D. Santi, A. R. M. Granata, and M. Simoni, “FSH treatment of male idiopathic infertility improves pregnancy rate: a meta-analysis.,” Endocr Connect, vol. 4, no. 3, pp. R46–R58, 2015.
P. Schlegel, M. Sigman, B. Collura, C. De Jonge, M. Eisenberg, and et al., “Diagnosis and Treatment of Infertility in Men: AUA/ ASRM Guideline.” [Online]. Available: https://www.auanet.org/guidelines-and-quality/guidelines/male-infertility
M. G. Showell, R. Mackenzie-Proctor, J. Brown, A. Yazdani, M. T. Stankiewicz, and R. J. Hart, “Antioxidants for male subfertility.,” Cochrane Database Syst Rev, vol. 12, p. CD007411, 2014.
 English Version: Causes and diagnosis of male infertility
English Version: Causes and diagnosis of male infertility
Urologielehrbuch.de ohne Werbung
Diese Internetseite ermöglicht mit Hilfe von Werbung den Volltext-Zugriff auf das aktuelle Urologielehrbuch.de. Viele Bilder sind zum Schutz von Laien verpixelt oder ausgeblendet. Regelmäßig wiederkehrende (fachkundige) Leser können die Werbebanner abschalten und Zugriff auf alle Abbildungen erhalten: Werden Sie Mitglied über die Crowdfunding-Plattform Steady und unterstützen Sie damit Urologielehrbuch.de.
Urologielehrbuch.de als Hardcover-Buch
 Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.
Aktuell, detailliert und übersichtlich: Urologielehrbuch.de wird auch als hochwertiges Hardcover-Buch veröffentlicht. Die 17. Auflage (Ausgabe 2024) ist seit Oktober 2024 verfügbar, siehe Abschnitt Neuigkeiten für die Aktualisierungen und Links für den Buchkauf.